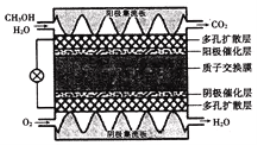
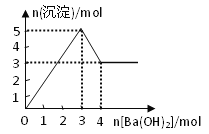
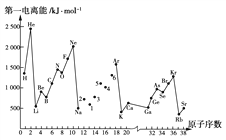
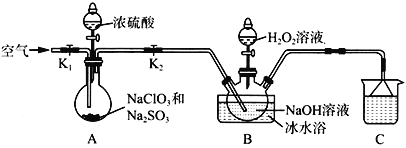
题目内容
【题目】甲、乙两烧杯各盛有100 mL 3 mol·L-1的盐酸和氢氧化钠溶液,向烧杯分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲∶乙=3∶4,则加入铝粉的质量为
A. 1.8 g B. 2.7 g C. 3.6 g D. 5.4 g
【答案】C
【解析】
本题主要考查铝的化学性质以及化学方程式的有关计算。根据铝的质量相同,盐酸和氢氧化钠溶液中溶质的物质的量相同,反应结束后测得生成的气体体积比为甲:乙=3:4,由化学反应方程式可知,酸与金属反应时酸不足,碱与金属反应时碱过量来计算解答。
盐酸和氢氧化钠溶液中溶质的物质的量均为0.1L×3mol/L=0.3mol,又两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=3:4,
设铝与酸反应时,酸完全反应,生成的氢气的物质的量为x,
则 2Al+6HCl═2AlCl3+3H2↑
6 3
0.3mol x
![]() ,解得x=0.15mol,一定条件下,气体的物质的量之比等于体积之比,则碱与金属铝反应生成的氢气的物质的量为0.15mol×
,解得x=0.15mol,一定条件下,气体的物质的量之比等于体积之比,则碱与金属铝反应生成的氢气的物质的量为0.15mol×![]() =0.2mol,
=0.2mol,
碱与金属铝反应时,铝完全反应,设与碱反应的铝的物质的量为y,
则2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2 3
y 0.2mol![]() ,解得y=
,解得y=![]() mol,其质量为
mol,其质量为![]() mol×27g/mol=3.6g。
mol×27g/mol=3.6g。

【题目】根据下列实验能得出相应结论的是
选项 | 实验 | 结论 |
A | 常温下,测得0.1mol/LNaA溶液的pH小于0.1mol/L Na2CO3溶液的pH | 酸性:HA>H2CO3 |
B | 向含有淀粉的FeI2溶液中加入足量溴水,溶液变蓝色 | 还原性:I->Fe2+ |
C | 向饱和FeSO4溶液中加入CuS固体,测得溶液中c(Fe2+)不变 | Ksp(CuS)<Ksp(FeS) |
D | 向氨水中滴加少量AgNO3溶液,无沉淀生成 | Ag+与NH3·H2O能大量共存 |
A. A B. B C. C D. D