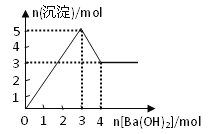
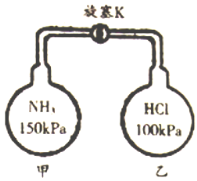
题目内容
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其化学方程式为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。(ClO2中氯元素的化合价为+4价)
(1)浓盐酸在反应中表现出来的性质是____________(填写编号);
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)当产生0.1 mol Cl2时,转移电子的数目为_____________;
(3)ClO2具有很强的氧化性,常用作消毒剂,其消毒的效率(以同质量的物质得到的电子数多少来衡量)是Cl2的______倍(结果小数点后保留两位)。
【答案】② 0.2NA 2.63
【解析】
(1)反应中盐酸表现为酸性和还原性;
(2)反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,据此计算转移电子物质的量;
(3)1molCl2可以获得2mol电子,1molClO2可以获得电子5mol电子。
(1)在反应2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O中,HCl中Cl元素的化合价由-1价升高0,则HCl具有还原性,又该反应生成盐KCl,则表现盐酸的酸性,
故答案为:②;
(2)反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,所以产生0.1molCl2,转移的电子的物质的量为0.1mol×2=0.2mol,转移电子数为0.2NA;
(3)设质量都是71g,氯气得到的电子数为71g/71g·mol-1×2×1=2mol,ClO2得到的电子数为71g/67.5g·mol-1×1×5=71×5/67.5mol=![]() mol,则ClO2消毒的效率是Cl2的倍数为
mol,则ClO2消毒的效率是Cl2的倍数为![]() mol:2mol=71/27≈2.63,
mol:2mol=71/27≈2.63,
故答案为:2.63。

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】根据下列实验能得出相应结论的是
选项 | 实验 | 结论 |
A | 常温下,测得0.1mol/LNaA溶液的pH小于0.1mol/L Na2CO3溶液的pH | 酸性:HA>H2CO3 |
B | 向含有淀粉的FeI2溶液中加入足量溴水,溶液变蓝色 | 还原性:I->Fe2+ |
C | 向饱和FeSO4溶液中加入CuS固体,测得溶液中c(Fe2+)不变 | Ksp(CuS)<Ksp(FeS) |
D | 向氨水中滴加少量AgNO3溶液,无沉淀生成 | Ag+与NH3·H2O能大量共存 |
A. A B. B C. C D. D