题目内容
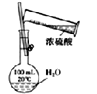
【题目】下图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O

(1)请回答:甲池是________________装置,B(石墨)电极的名称是_____________________。
(2)写出下列电极反应式:通入CH3OH的电极的电极反应式是___________________________,A(Fe)电极的电极反应式为___________________________。
(3)乙池中反应的化学方程式为___________________________。
(4)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗标准状况下的氧气___________mL。
【答案】原电池 阳极 CH3OH+8OH--6 e-=CO32-+6H2O Ag++e-=Ag 4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3 280
4Ag+O2↑+4HNO3 280
【解析】
甲池能自发的进行氧化还原反应,所以是原电池,则乙池是电解池。
(1)根据外加电源名称确定乙装置石墨电极名称;
(2)先判断原电池、电解池的电极名称,再写出相应的电极反应式;
(3)根据离子放电顺序写出相应的电解反应方程式;
(4)先根据得失电子数相等找出银与氧气的关系式,然后计算。
根据反应方程式知,甲装置是一个原电池,乙有外加电源,所以是电解池。
(1)由图可知,甲装置是一个原电池,CH3OH发生氧化反应,所以该电极是负极,O2发生还原反应,所以该电极是正极;石墨与原电池的正极相连,所以石墨电极是阳极,
故答案为:原电池,阳极。
(2)根据2CH3OH+3O2+4KOH=2K2CO3+6H2O知,CH3OH发生氧化反应,所以该电极是负极,CH3OH与氢氧根共同得电子生成碳酸根离子和水;铁电极是阴极,该电极上银离子得电子发生还原反应,
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;4Ag++4e-=4Ag。
(3)乙池中离子放电顺序为:阳离子Ag+>H+,阴离子OH->NO3-,所以电池反应式为4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3,故答案为:4AgNO3+2H2O
4Ag+O2↑+4HNO3,故答案为:4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3。
4Ag+O2↑+4HNO3。
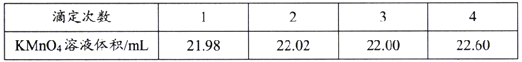
(4)根据得失电子数相等,氧气与银的关系式为:O2~4Ag,则氧气的体积=22.4L×5.40g÷(4×108g/mol)=0.28L=280mL,故答案为:280。

 阅读快车系列答案
阅读快车系列答案【题目】三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产NiCl2,继而生产Ni2O3的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 1.8 | 5.8 | 3.0 | 7.1 |
沉淀完全的pH | 3.2 | 8.8 | 5.0 | 9.2 |
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有①适当升高温度;②搅拌;③________等。
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等。沉镍前需加Na2CO3控制溶液pH范围为____________________。
(3)从滤液A中可回收利用的主要物质是Na2CO3和________。
(4)“氧化”生成Ni2O3的离子方程式为__________________________________。
(5)工业上用镍为阳极,电解0.05~0.1 mol·L-1 NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示,则①NH4Cl的浓度最好控制为__________________________。
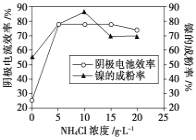
②当NH4Cl的浓度大于15g·L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:________________________。
(6)如果在“沉镍”步骤把Na2CO3改为加草酸,则可以制得草酸镍晶体(NiC2O4·2H2O)。草酸镍晶体在热空气中干燥脱水后在高温下煅烧三小时,可以制得Ni2O3,同时获得混合气体。草酸镍晶体受热分解的化学方程式为___________________________________。