题目内容
A、B、C、D、E、F六种短周期元素的原子序数依次增大.A是宇宙中含量最丰元素,B元素的原子价电子排布为nsnnpn,D元素的最外层电子数是其电子层数的3倍,F的最高价氧化物对应水化物有两性,能溶于C、E的最高价氧化物对应水化物中.试回答:
(1)写出C原子的价层电子轨道表示式: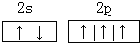
 ;D原子的价层电子排布式:
;D原子的价层电子排布式: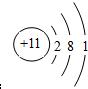
 ;
;
(2)B位于元素周期表的第
(3)C的基态原子核外有
(4)E单质在空气中燃烧生成物的电子式: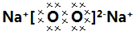
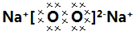 ,其中的阳离子与阴离子的个数比是
,其中的阳离子与阴离子的个数比是
(5)F的固态氧化物的用途有
(1)写出C原子的价层电子轨道表示式:


2s22p4
2s22p4
,E的原子结构示意图:

(2)B位于元素周期表的第
IVA
IVA
族,A、B形成原子个数比1:1且直线形分子的结构式:H-C≡C-H
H-C≡C-H
;(3)C的基态原子核外有
7
7
种不同运动状态的电子;(4)E单质在空气中燃烧生成物的电子式:
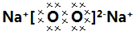
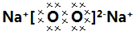
2:1
2:1
;(5)F的固态氧化物的用途有
耐火材料
耐火材料
(说出一种).F的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的两种化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是4Al+3TiO2+3C
2Al2O3+3TiC
| ||
4Al+3TiO2+3C
2Al2O3+3TiC
.
| ||
分析:A是宇宙中含量最丰元素,所以A是H元素;B元素的原子价电子排布为nsnnpn,n为2,所以价电子排布为2s22p2,为C元素;D元素的最外层电子数是其电子层数的3倍,电子层数是2,所以最外层电子数是6,为O元素,则C是N元素;F的最高价氧化物对应水化物有两性,所以F是Cl元素,能溶于C、E的最高价氧化物对应水化物中,且E的原子序数小于F,所以E是Na元素,结合各元素对应的单质、化合物的性质解答该题.
解答:解:A是宇宙中含量最丰元素,所以A是H元素;B元素的原子价电子排布为nsnnpn,n为2,所以价电子排布为2s22p2,为C元素;D元素的最外层电子数是其电子层数的3倍,电子层数是2,所以最外层电子数是6,为O元素,则C是N元素;F的最高价氧化物对应水化物有两性,所以F是Cl元素,能溶于C、E的最高价氧化物对应水化物中,且E的原子序数小于F,所以E是Na元素.
(1)通过以上分析知,C是N元素,氮原子价电子层上有5个电子,2s轨道上有2个电子,2p有3个电子,分别在不同的轨道上且自旋方向相同,其价电子的轨道表示式为: ;D是氧元素,价电子是其最外层电子,有6个电子,2s轨道上有2个电子,2p有4个电子,其价电子排布式为:2s22p4;E是钠元素,原子核外有11个电子,其原子结构示意图为:
;D是氧元素,价电子是其最外层电子,有6个电子,2s轨道上有2个电子,2p有4个电子,其价电子排布式为:2s22p4;E是钠元素,原子核外有11个电子,其原子结构示意图为: .
.
故答案为: ;2s22p4;
;2s22p4; .
.
(2)主族元素的最外层电子数等于其族序数,碳元素最外层上有4个电子,所以位于第IVA族;H、C形成原子个数比1:1且直线形分子是乙炔,它的结构式为:H-C≡C-H.
故答案为:IVA;H-C≡C-H.
(3)原子核外各电子的运动状态都不相同,所以原子核外有几个电子就有几种运动状态,N原子核外有7个电子,所以有7种运动状态.
故答案为:7.
(4)钠在空气中燃烧生成过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键,氧原子和氧原子之间存在共价键,其电子式为: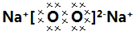 ;一个过氧化钠化学式中含有2个钠离子和一个过氧根离子,所以阳离子和阴离子个数之比为2:1.
;一个过氧化钠化学式中含有2个钠离子和一个过氧根离子,所以阳离子和阴离子个数之比为2:1.
故答案为: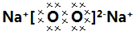 ;2:1.
;2:1.
(5)氧化铝熔点很高,所以可以用作耐火材料(砖);铝、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的两种化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),所以生成物分别是氧化铝和碳化钛,反应方程式为:4Al+3TiO2+3C
2Al2O3+3TiC.
故答案为:耐火材料;4Al+3TiO2+3C
2Al2O3+3TiC.
(1)通过以上分析知,C是N元素,氮原子价电子层上有5个电子,2s轨道上有2个电子,2p有3个电子,分别在不同的轨道上且自旋方向相同,其价电子的轨道表示式为:
 ;D是氧元素,价电子是其最外层电子,有6个电子,2s轨道上有2个电子,2p有4个电子,其价电子排布式为:2s22p4;E是钠元素,原子核外有11个电子,其原子结构示意图为:
;D是氧元素,价电子是其最外层电子,有6个电子,2s轨道上有2个电子,2p有4个电子,其价电子排布式为:2s22p4;E是钠元素,原子核外有11个电子,其原子结构示意图为: .
.故答案为:
 ;2s22p4;
;2s22p4; .
.(2)主族元素的最外层电子数等于其族序数,碳元素最外层上有4个电子,所以位于第IVA族;H、C形成原子个数比1:1且直线形分子是乙炔,它的结构式为:H-C≡C-H.
故答案为:IVA;H-C≡C-H.
(3)原子核外各电子的运动状态都不相同,所以原子核外有几个电子就有几种运动状态,N原子核外有7个电子,所以有7种运动状态.
故答案为:7.
(4)钠在空气中燃烧生成过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键,氧原子和氧原子之间存在共价键,其电子式为:
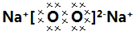 ;一个过氧化钠化学式中含有2个钠离子和一个过氧根离子,所以阳离子和阴离子个数之比为2:1.
;一个过氧化钠化学式中含有2个钠离子和一个过氧根离子,所以阳离子和阴离子个数之比为2:1.故答案为:
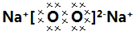 ;2:1.
;2:1.(5)氧化铝熔点很高,所以可以用作耐火材料(砖);铝、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的两种化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),所以生成物分别是氧化铝和碳化钛,反应方程式为:4Al+3TiO2+3C
| ||
故答案为:耐火材料;4Al+3TiO2+3C
| ||
点评:本题元素的推断为载体考查了元素化合物的性质、原子结构的有关知识,能正确推断元素是解本题的关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.