题目内容
下列有关Na2CO3和NaHCO3的性质的比较中,前者小于后者的是( )
| A、热稳定性 |
| B、常温时的溶解度 |
| C、常温时同浓度的pH |
| D、与含1mol HCl的盐酸完全反应时所需的物质的量 |
考点:钠的重要化合物
专题:元素及其化合物
分析:A.碳酸氢钠受热易分解;
B.相同条件下,碳酸钠的溶解度大;
C.碳酸钠水解程度大于碳酸氢钠;
D.结合反应的方程式判断.
B.相同条件下,碳酸钠的溶解度大;
C.碳酸钠水解程度大于碳酸氢钠;
D.结合反应的方程式判断.
解答:
解:A.NaHCO3不稳定,加热易分解:2NaHCO3
Na2CO3+CO2↑+H2O,对热稳定性:Na2CO3>NaHCO3,故A错误;
B.常温下,向饱和碳酸钠溶液中通入二氧化碳气体,有碳酸氢钠晶体析出,可知常温时水溶解性:Na2CO3>NaHCO3,故B错误;
C.碳酸根离子的水解程度大于碳酸氢根离子,且CO32-以第一步水解为主,则等浓度的溶液,Na2CO3溶液的碱性较强,故C错误;
D.由CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑可知,与含1mol HCl的盐酸完全反应时,需要的NaHCO3物质的量较大,故D正确.
故选D.
| ||
B.常温下,向饱和碳酸钠溶液中通入二氧化碳气体,有碳酸氢钠晶体析出,可知常温时水溶解性:Na2CO3>NaHCO3,故B错误;
C.碳酸根离子的水解程度大于碳酸氢根离子,且CO32-以第一步水解为主,则等浓度的溶液,Na2CO3溶液的碱性较强,故C错误;
D.由CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑可知,与含1mol HCl的盐酸完全反应时,需要的NaHCO3物质的量较大,故D正确.
故选D.
点评:本题考查Na2CO3和NaHCO3性质的异同,题目难度不大,注意把握Na2CO3和NaHCO3性质,选项D为解答的易错点,注重基础知识的积累.

练习册系列答案
相关题目
相同温度下,在水中分别加入下列物质,若用KW表示水的离子积,α表示水的电离度,能使
的值增大的是( )
| α |
| KW |
| A、NaOH |
| B、NaHSO4 |
| C、NH4NO3 |
| D、KCl |
漆酚( )是我国特产生漆的主要成分,通常情况下为黄色液体,能溶于有机溶剂,生漆涂在物体的表面,在空气中干燥后变成黑色的漆膜.将漆酚放入下列物质中:①空气 ②溴水 ③小苏打溶液 ④氯化铁溶液 ⑤通入过量的二氧化碳,不能发生化学反应的是( )
)是我国特产生漆的主要成分,通常情况下为黄色液体,能溶于有机溶剂,生漆涂在物体的表面,在空气中干燥后变成黑色的漆膜.将漆酚放入下列物质中:①空气 ②溴水 ③小苏打溶液 ④氯化铁溶液 ⑤通入过量的二氧化碳,不能发生化学反应的是( )
 )是我国特产生漆的主要成分,通常情况下为黄色液体,能溶于有机溶剂,生漆涂在物体的表面,在空气中干燥后变成黑色的漆膜.将漆酚放入下列物质中:①空气 ②溴水 ③小苏打溶液 ④氯化铁溶液 ⑤通入过量的二氧化碳,不能发生化学反应的是( )
)是我国特产生漆的主要成分,通常情况下为黄色液体,能溶于有机溶剂,生漆涂在物体的表面,在空气中干燥后变成黑色的漆膜.将漆酚放入下列物质中:①空气 ②溴水 ③小苏打溶液 ④氯化铁溶液 ⑤通入过量的二氧化碳,不能发生化学反应的是( )| A、①②⑤ | B、③④ | C、②⑤ | D、③⑤ |
下列叙述正确的是( )
A、25℃时,若0.1mol/L氨水溶液中
| ||
B、25℃时,将0.1mol/L醋酸溶液加水稀释,保持温度不变,稀释过程中
| ||
| C、0.1mol/L的Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | ||
| D、浓度均为0.1mol/L的氨水溶液和NH4Cl溶液等体积混合后,若溶液呈碱性,则所得溶液中:c(NH4+)>c(NH3?H2O)>c(Cl-)>c(OH-)>c(H+) |
将a mol小苏打和b mol过氧化钠置于某体积可变的密闭容器中充分加热,反应后测得容器内的氧气为1mol,下列说法一定正确的是( )
| A、b=2 |
| B、反应中转移的电子数一定为2NA |
| C、容器中一定没有残余的CO2和水蒸气 |
| D、a:b≥1 |
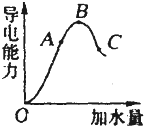 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.请回答: