题目内容
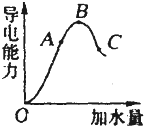 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.请回答:(1)“O”点导电能力为“0”的理由是
(2)A、B、C三点pH值由大到小的顺序是
(3)A、B、C三点醋酸电离程度最大的是
(4)若使C点溶液中[CH3COO-]增大,而[H+]减小,可采取的措施
有:①
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:(1)溶液的导电能力与离子浓度成正比;
(2)溶液的导电能力越大,则离子浓度越大,氢离子浓度越大,溶液的pH越小;
(3)相同温度下,醋酸的浓度越小,其电离程度越大;
(4)若使C点溶液中[CH3COO-]增大,而[H+]减小,可以向溶液中加入某些和氢离子反应的物质.
(2)溶液的导电能力越大,则离子浓度越大,氢离子浓度越大,溶液的pH越小;
(3)相同温度下,醋酸的浓度越小,其电离程度越大;
(4)若使C点溶液中[CH3COO-]增大,而[H+]减小,可以向溶液中加入某些和氢离子反应的物质.
解答:
解:(1)冰醋酸只有在水溶液中电离,“O”点时为纯醋酸,难电离,没有自由移动的离子,可视为不导电;
故答案为:冰醋酸只有在水溶液中电离,“O”点时为纯醋酸,难电离,可视为不导电;
(2)溶液的导电能力越大,则离子浓度越大,氢离子浓度越大,溶液的pH越小,根据图象知,氢离子浓度大小顺序是B>A>C,则溶液的pH大小顺序是C>A>B,
故答案为:C>A>B;
(3)相同温度下,醋酸的浓度越小,其电离程度越大,根据图象知,酸的浓度最小的是C点,则C点醋酸电离程度最大,故答案为:C;
(4)若使C点溶液中[CH3COO-]增大,而[H+]减小,可以向溶液中加入某些和氢离子反应的物质,如碱、酸性小于醋酸的盐、活泼金属等,
故答案为:①加NaOH(s);②加Na2CO3(s);③加入活泼金属(如锌、镁等).
故答案为:冰醋酸只有在水溶液中电离,“O”点时为纯醋酸,难电离,可视为不导电;
(2)溶液的导电能力越大,则离子浓度越大,氢离子浓度越大,溶液的pH越小,根据图象知,氢离子浓度大小顺序是B>A>C,则溶液的pH大小顺序是C>A>B,
故答案为:C>A>B;
(3)相同温度下,醋酸的浓度越小,其电离程度越大,根据图象知,酸的浓度最小的是C点,则C点醋酸电离程度最大,故答案为:C;
(4)若使C点溶液中[CH3COO-]增大,而[H+]减小,可以向溶液中加入某些和氢离子反应的物质,如碱、酸性小于醋酸的盐、活泼金属等,
故答案为:①加NaOH(s);②加Na2CO3(s);③加入活泼金属(如锌、镁等).
点评:本题考查了弱电解质的电离,明确弱电解质的电离程度与溶液浓度的关系、溶液导电能力与离子浓度的关系即可解答,溶液导电能力与电解质强弱无关,为易错点.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
NA代表阿伏伽德罗常数的值,下列说法正确的是( )
| A、5.6g铁在足量氯气中燃烧,电子转移0.3NA个 |
| B、标准状况下,2.24L水中含有0.1NA个水分子 |
| C、1.12L氯气中反应0.1NA个氯原子 |
| D、12g石墨和C60的混合固体中,含碳原子NA个 |
下列说法不正确的是( )
| A、在一定条件下,催化分解80g SO3,混合气体中氧原子数为3×6.02×1023 |
| B、一定条件下,铁与水蒸气反应生成8.96L H2时(已折合成标况),转移的电子数为0.8×6.02×1023 |
| C、100mL 1mol/L AlCl3与3mol/L NaCl的混合溶液中,Cl-的个数为0.6×6.02×1023 |
| D、含有非极性键的数目为6.02×1023的Na2O2与水充分反应,标况下产生O2 22.4L |
下列有关Na2CO3和NaHCO3的性质的比较中,前者小于后者的是( )
| A、热稳定性 |
| B、常温时的溶解度 |
| C、常温时同浓度的pH |
| D、与含1mol HCl的盐酸完全反应时所需的物质的量 |
下列各组物质发生化学反应时,由于反应物的量不同而导致生成不同产物的是( )
①CO2与NaOH溶液
②盐酸溶液与偏铝酸钠
③NaHCO3溶液与盐酸
④C与O2
⑤AlCl3溶液与氢氧化钠溶液.
①CO2与NaOH溶液
②盐酸溶液与偏铝酸钠
③NaHCO3溶液与盐酸
④C与O2
⑤AlCl3溶液与氢氧化钠溶液.
| A、除③外 | B、除②外 |
| C、除②③⑤外 | D、除②⑤外 |
验证汽油是混合物的方法是( )
| A、测量密度 | B、测沸点 |
| C、将汽油点燃 | D、闻气味 |