��Ŀ����
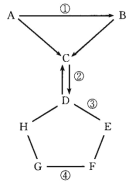
����Ŀ�������ʾΪԪ�����ڱ���һ���֣�����Ԫ�آ١����ڱ��е�λ�ã���ش��������⣺
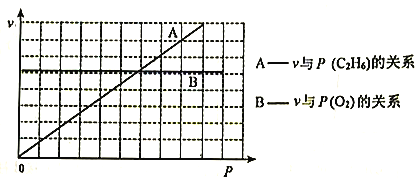
��A | 0 | |||||||
1 | �� | ��A | ��A | ��A | ��A | ��A | ��A | |
2 | �� | �� | �� | �� | ||||
3 | �� | �� | �� | �� | ||||
(1)�ۡ��ܡ��ߵ�ԭ�Ӱ뾶�ɴ�С��˳����________(��Ԫ�ط��ű�ʾ)��
(2)������ʵ��˵��Ԫ�آڵķǽ����Ա�Ԫ�آķǽ�����ǿ����________(����ĸ)��
A.�ڵĵ�����Ԫ�آļ��⻯����Һ��Ӧ����Һ�����
B.��������ԭ��Ӧ�У�1mol�ڵ��ʱ�1mol���ʵõ��Ӷ�
C.�ں͢���Ԫ�صļ��⻯�����ȷֽ⣬ǰ�ߵķֽ��¶ȸ�
(3)�١�������Ԫ�ذ�ԭ�Ӹ���֮��Ϊ1��1��ɵij���Һ̬�������������Һ���ܽ�Fe2��������д���÷�Ӧ�����ӷ���ʽ�� ____��
(4)��֪���ڱ��д��ڶԽ����ƹ�������(Be)������ѧ�������ƣ�����������������Ҳ�����ԣ�д���������������ܵ�����������ˮ���ﷴӦ�Ļ�ѧ����ʽ��________��
(5)��֪W+X=Y+Z(��Ӧ��Ҫ����)��W��X��Y��Z�ֱ����ɢ٢ڢ�����Ԫ���γɵ�����10��������(W��XΪ���ӣ�Y��ZΪ����)��д�������ӷ���ʽ___________
���𰸡�Na>Cl>F AC H2O2+2Fe2��+2H��=2Fe3��+2H2O Be(OH)2+2NaOH=Na2BeO2+2H2O NH4++OH-![]() NH3��+H2O
NH3��+H2O
��������
����Ԫ�������ڱ��е�λ�ã���֪��ΪH����ΪO����ΪF����ΪNa����ΪAl����ΪS����ΪCl����ΪBe����ΪN��
(1)ͬ�����������ԭ�Ӱ뾶��С��ͬ�������϶���ԭ�Ӱ뾶����
(2)���Ը��ݶ�Ӧ���������ԡ��⻯���ȶ��Ե��ж�Ԫ�طǽ�����ǿ���������ܸ��ݵ�ʧ�������жϷǽ����ԣ�
(3)�١�������Ԫ�ذ�ԭ�Ӹ���֮��Ϊ1��1��ɵij���Һ̬������ΪH2O2�������ʾ��������ԣ���������Һ���ܽ�Fe2+����Fe3+��ͬʱ����ˮ��
(4)�������������ǿ�Ӧ�����κ�ˮ��
(5)��֪W+X=Y+Z��W��X��Y��Z�ֱ����ɢ٢ڢ�����Ԫ���γɵ�����10�������ӣ�Ӧ��Ϊ笠����������������ӵķ�Ӧ���ݴ���д��Ӧ����ʽ��
����Ԫ�������ڱ��е�λ�ã�����֪����ΪH����ΪO����ΪF����ΪNa����ΪAl����ΪS����ΪCl����ΪBe����ΪN��
(1)ͬһ���ڵ�Ԫ�أ�ԭ������Խ��ԭ�Ӱ뾶ԽС��ͬһ�����Ԫ�أ�ԭ�Ӻ�����Ӳ���Խ�࣬ԭ�Ӱ뾶Խ������ԭ�Ӱ뾶��СΪ��Na>Cl>F��
(2)A.OԪ�ص���O2��H2S��Һ��Ӧ��ʹ��Һ����ǣ�����˵��O2�������Դ���S���ܹ�֤��O�ķǽ����Խ�ǿ��A��ȷ��
B.��ʧ������������Ԫ�طǽ�����ǿ��û�б�Ȼ��ϵ��Ӧ�ø���Ԫ�صõ����ӵ����ף�������ݴ��жϷǽ�����ǿ����B����
C.Ԫ���γɵļ��⻯���ȶ���Խǿ����ǽ�����Խǿ��O��S��Ԫ�صļ��⻯�����ȷֽ⣬ǰ�߷ֽ��¶ȸߣ�˵��OԪ�صķǽ����Խ�ǿ��C��ȷ��
�ʴ����ѡ����AC��
(3)�١�������Ԫ�ذ�ԭ�Ӹ���֮��Ϊ1��1��ɵij���Һ̬������ΪH2O2����������Һ���ܽ�Fe2+����Fe3+��ͬʱ����ˮ������ԭ���غ㡢�����غ㡢����غ㣬�ɵø÷�Ӧ�����ӷ���ʽΪ��H2O2+2Fe2��+2H��=2Fe3��+2H2O��
(4)�������������ǿ�Ӧ�����κ�ˮ��������������Be(OH)2��ǿ��NaOH��Һ��Ӧ���������ƺ�ˮ����Ӧ�Ļ�ѧ����ʽΪBe(OH)2+2NaOH=Na2BeO2+2H2O��
(5)��֪W+X=Y+Z��W��X��Y��Z�ֱ����ɢ٢ڢ�����Ԫ���γɵ�����10�������ӣ�Ӧ��ΪNH4+��OH-��Ӧ��������NH3��H2O���ȷֽ����NH3��ˮ���÷�Ӧ�����ӷ���ʽΪ��NH4++OH-![]() NH3��+H2O��
NH3��+H2O��

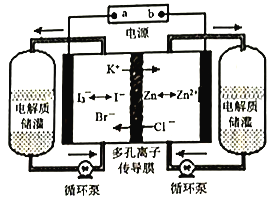
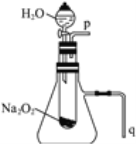
����Ŀ����ѧ��ȤA���ͬѧ�����÷�������Һ�Ʊ�K2SO4���壬�����������ͼ��ʾ:
(1)д����Ӧ��Ļ�ѧ����ʽ��______________________��
(2)��Ӧ��������һ�ֿ��������ϵ�����M��M�Ļ�ѧʽΪ_________________��
(3)���������п�ѭ��ʹ�õ�������CO2��_________(�ѧʽ)��
(4)��Ӧ�������������25��ʱ���ܽ�����±���
���� |
|
|
|
|
�ܽ��/g | 34.0 | 11.1 | 37.2 | 19.5 |
��Ӧ���ڳ�����(25��)��ʵ�ֵ�ԭ����_________________________��
(5)����ˮ���ñ���K2SO4��Һϴ�ӷ�Ӧ�����þ����ԭ����_____________��Ϊ�˼���˾����Ƿ�ϴ�Ӹɾ���ȡ���һ��ϴ��Һ���Թ��У��ȼ��������_______(ѡ����ĸ)�������ã� �����ϲ���Һ�еμ�_______(ѡ����ĸ)���۲������жϸþ����Ƿ�ϴ�Ӹɾ���
A. AgNO3��Һ B. BaCl2��Һ C. Ba(NO3)2��Һ D .Ba(OH)2��Һ E. NaOH��Һ
����Ŀ��������
(1)ij�ز�ʯ��ʯ�������ʲ�����ˮҲ�������ᷴӦ��Ϊ�ⶨ��ʯ��ʯ��̼��Ƶĺ������ֽ�������ʵ�飺��ȡ25gʯ��ʯ��������Ϊ145g���ձ��У������м���100gϡ���ᣬ��Ӧǡ����ȫ����ʱ�����ձ���������Һ��������Ϊ261.2g����
��ʯ��ʯ��̼��Ƶ�����Ϊ__________�ˡ�
�ڷ�Ӧ����Һ�����ʵ���������Ϊ__________(������λ��Ч����)��
(2)ij����ij������ĩ28.36 g������ֻ��Fe��C�������������г�ַ�Ӧ��������������ͨ�������ij���ʯ��ˮ�У��õ�3 g��ɫ������
�ټ���ɵô˸�����ĩ������̼������֮��Ϊ__________��
����ȡ���ݲ�ͬ�����ĸ�����ĩ�ֱ�ӵ�50g����������ͬ�������У���ַ�Ӧ��õ�ʵ���������±���ʾ������״���£�2�� H2�����Ϊ22.4L��
ʵ����� | �� | �� | �� |
���������ĩ������ / g | 2.836 | 5.672 | 8.508 |
����������������״����/ L | 1.12 | 2.24 | 2.80 |
���ݱ��е����ݼ��㣬������Һ��H2SO4���ʵ�����������__________