题目内容
【题目】营养平衡、科学使用食品添加剂有助于健康和提高免疫力。

(1)维生素C又称抗坏血酸,在氯化铁溶液中加入维生素C后,溶液由黄色转变为浅绿色,说明维生素C具有较强的________性(填“氧化”或“还原”)。
(2)某种食品的配料标签如图所示。该配料中,属于防腐剂的是________,蛋白质在人体内水解的最终产物是氨基酸,氨基酸结构中含有的官能团有氨基和____________(填结构简式)。
(3)“阿司匹林”是一种解热镇痛药,遇潮湿空气或水能缓慢水解生成水杨酸(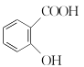 )和醋酸,写出该反应的化学方程式:__________________________。
)和醋酸,写出该反应的化学方程式:__________________________。
【答案】还原 苯甲酸钠 —COOH 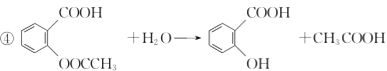
【解析】
(1)氯化铁溶液中加入维生素C后,溶液由黄色转变为浅绿色,说明铁离子转化为亚铁离子,维生素C具有较强的还原性;
(2)小麦粉富含淀粉,鸡蛋富含蛋白质,蔗糖属于糖类,碳酸氢钠具有碱性,以上均不不是防腐剂;苯甲酸钠是防腐剂;蛋白质在人体内水解的最终产物是氨基酸,氨基酸结构中含有的官能团有氨基和羧基—COOH;
(3)“阿司匹林”是一种解热镇痛药,遇潮湿空气或水能缓慢水解生成水杨酸(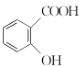 )和醋酸,反应的化学方程式为:
)和醋酸,反应的化学方程式为: 。
。

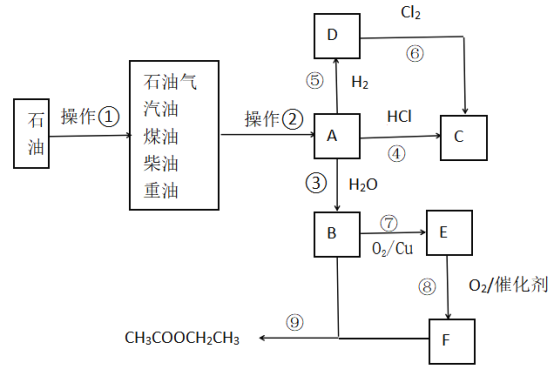
【题目】甲醇是重要的化工原料,又可作为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=+41 kJ/mol
CO(g)+H2O(g) ΔH=+41 kJ/mol
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | x |
则x=_________。
(2)若将lmol CO2和2mol H2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应②。测得CH3OH的物质的量随时间的变化如图所示。

①曲线I、Ⅱ对应的平衡常数大小关系为KI_____KⅡ(填“>”或“=”或“<”);
②一定温度下,能判断该反应达到化学平衡状态的是_____________。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=O断裂的同时有6个H—H断裂
③若5min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率________;该温度下的平衡常数为______;若保持容器温度不变,下列措施可增加甲醇产率的________。
a.缩小反应容器的容积 b.使用合适的催化剂
c.充入He d.按原比例再充入CO2和H2
【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装 置 |
|
|
|
|
部分实验现象 | a极质量减小;b极质量增加 | b极有气体产生;c极无变化 | d极溶解;c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
【题目】如表所示为元素周期表的一部分,参照元素①~⑨在表中的位置,请回答下列问题:
ⅠA | 0 | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ⑧ | ⑨ | ② | ③ | ||||
3 | ④ | ⑤ | ⑥ | ⑦ | ||||
(1)③、④、⑦的原子半径由大到小的顺序是________(用元素符号表示)。
(2)下列事实能说明元素②的非金属性比元素⑥的非金属性强的是________(填字母)。
A.②的单质与元素⑥的简单氢化物溶液反应,溶液变浑浊
B.在氧化还原反应中,1mol②单质比1mol⑥单质得电子多
C.②和⑥两元素的简单氢化物受热分解,前者的分解温度高
(3)①、②两种元素按原子个数之比为1∶1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式: ____。
(4)已知周期表中存在对角相似规则,如铍(Be)与铝化学性质相似,⑧的氧化物、氢氧化物也有两性,写出⑧的氢氧化物与④的最高价氧化物的水化物反应的化学方程式:________。
(5)已知W+X=Y+Z(反应需要加热),W、X、Y、Z分别是由①②⑨三种元素形成的四种10电子粒子(W、X为离子,Y、Z为分子),写出该离子方程式___________