题目内容
【题目】乙烯是重要的基本化工原料,以乙烷为原料生产乙烯有多种方法。
I.乙烷裂解脱氢法。该方法的反应为:C2H6(g)=C2H4(g)+H2(g) △H= a kJ·mol-1
(1)已知101kPa,298K时,C(s)和H2(g)生成lmoC2H6(g)、1molC2H4(g)的△H分别为-84.7 kJ·mol-1、+52.3 kJ·mol-1。则a=___________。
II.乙烧氧化脱氢法,在原料气中加入氧气,乙烷氧化脱氢的反应如下:
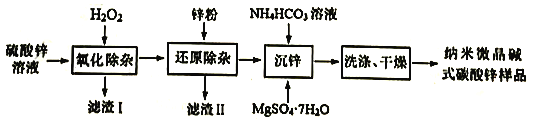
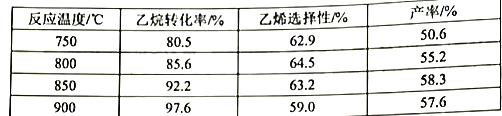
2C2H6(g)+O2(g)![]() 2C2H4(g)+2H2O(g) △H<0,副反应都为放热反应,副产物有CH4(g)、CO(g)、CO2(g)。原料气(70.1%空气、29.9%C2H6)在反应器中停留15s,获得相关数据如下表:
2C2H4(g)+2H2O(g) △H<0,副反应都为放热反应,副产物有CH4(g)、CO(g)、CO2(g)。原料气(70.1%空气、29.9%C2H6)在反应器中停留15s,获得相关数据如下表:
(2)①反应的平衡常数表达式为K=___________,K(750℃)___________K(900℃)(填“>”、“<”、“=”)
②当温度超过800℃时,乙烯的选择性降低,其主要原因可能是___________。根据表中数据选择适宜的反应温度为___________。
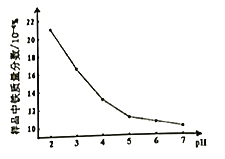
III.催化氧化脱氢法。以Mo-V-Nb-Sb的氧化物为催化剂,在常压、380℃下,反应速率与氧气分压[P(O2)]、乙烷分压[P(C2H6)的关系如下图所示。
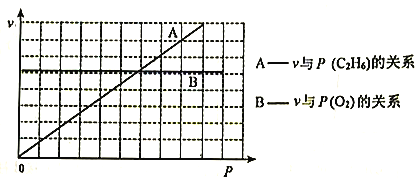
(3)已知该反应的速率方程为v=kPm(O2)·Pn(C2H6),则m=___________,n=___________。
IV质子膜燃料电池法。
(4)乙烷氧化制乙烯会产生CO2的大量排放,近年研究人员开发了乙烷氧化制乙烯的质子膜燃料电池(SOFC),该燃料电池的负极反应式为______________________,这种电池工作过程中没有CO2排放,原因是______________________。
【答案】+137.0 K=![]() > 副反应速率变大(或副反应增多) 850℃ 0 1 C2H6-2e-=C2H4+2H+ 质子膜将氧气和乙烷、乙烯隔开,使脱氢和氧化分开进行,所以没有CO2产生
> 副反应速率变大(或副反应增多) 850℃ 0 1 C2H6-2e-=C2H4+2H+ 质子膜将氧气和乙烷、乙烯隔开,使脱氢和氧化分开进行,所以没有CO2产生
【解析】
(1)已知101kPa,298K时,C(s)和H2(g)生成lmoC2H6(g)、1molC2H4(g)的△H分别为-84.7 kJ·mol-1、+52.3 kJ·mol-1。则有①2C(s)+3H2(g)=C2H6(g) △H1=-84.7 kJ·mol;②2C(s)+2H2(g)= C2H4 (g) △H2=+52.3 kJ·mol-1;根据盖斯定律,由②-①得反应③C2H6(g)=C2H4(g)+H2(g)△H=a kJ·mol-1,则a=+137.0;
(2)①反应2C2H6(g)+O2(g)![]() 2C2H4(g)+2H2O(g)的平衡常数表达式为K=
2C2H4(g)+2H2O(g)的平衡常数表达式为K=![]() ;
;
根据表中数据可知,升高温度乙烷的转化率增大,平衡正向移动,则K减小,故K(750℃) >K(900℃);
②当温度超过800℃时,副反应速率变大(或副反应增多),乙烯的选择性降低;
根据表中数据,乙烷转化率较高、乙烯转化率较高且产率较高,故选择适宜的反应温度为850℃;
(3)已知该反应的速率方程为v=kPm(O2)·Pn(C2H6),根据图中信息可知v与Pm(O2)的关系保持不变,故m=0,v与Pn(C2H6)的关系保持正比关系且横纵坐标相等,故n=1;
(4)乙烷氧化制乙烯会产生CO2的大量排放,近年研究人员开发了乙烷氧化制乙烯的质子膜燃料电池(SOFC),该燃料电池的负极乙烷在酸性条件下失去电子产生乙烯,电极反应式为C2H6-2e-=C2H4+2H+,这种电池工作过程中没有CO2排放,原因是质子膜将氧气和乙烷、乙烯隔开,使脱氢和氧化分开进行,所以没有CO2产生。

【题目】甲醇是重要的化工原料,又可作为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=+41 kJ/mol
CO(g)+H2O(g) ΔH=+41 kJ/mol
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | x |
则x=_________。
(2)若将lmol CO2和2mol H2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应②。测得CH3OH的物质的量随时间的变化如图所示。

①曲线I、Ⅱ对应的平衡常数大小关系为KI_____KⅡ(填“>”或“=”或“<”);
②一定温度下,能判断该反应达到化学平衡状态的是_____________。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=O断裂的同时有6个H—H断裂
③若5min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率________;该温度下的平衡常数为______;若保持容器温度不变,下列措施可增加甲醇产率的________。
a.缩小反应容器的容积 b.使用合适的催化剂
c.充入He d.按原比例再充入CO2和H2
【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装 置 |
|
|
|
|
部分实验现象 | a极质量减小;b极质量增加 | b极有气体产生;c极无变化 | d极溶解;c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
【题目】如表所示为元素周期表的一部分,参照元素①~⑨在表中的位置,请回答下列问题:
ⅠA | 0 | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ⑧ | ⑨ | ② | ③ | ||||
3 | ④ | ⑤ | ⑥ | ⑦ | ||||
(1)③、④、⑦的原子半径由大到小的顺序是________(用元素符号表示)。
(2)下列事实能说明元素②的非金属性比元素⑥的非金属性强的是________(填字母)。
A.②的单质与元素⑥的简单氢化物溶液反应,溶液变浑浊
B.在氧化还原反应中,1mol②单质比1mol⑥单质得电子多
C.②和⑥两元素的简单氢化物受热分解,前者的分解温度高
(3)①、②两种元素按原子个数之比为1∶1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式: ____。
(4)已知周期表中存在对角相似规则,如铍(Be)与铝化学性质相似,⑧的氧化物、氢氧化物也有两性,写出⑧的氢氧化物与④的最高价氧化物的水化物反应的化学方程式:________。
(5)已知W+X=Y+Z(反应需要加热),W、X、Y、Z分别是由①②⑨三种元素形成的四种10电子粒子(W、X为离子,Y、Z为分子),写出该离子方程式___________