题目内容
【题目】某研究所研制的锌碘液流电池,使用寿命长,可自我恢复。锌碘液流电池充电的工作原理如图所示,下列说法正确的是
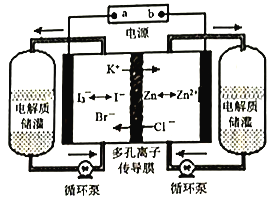
A. 放电时,正极反应式是I3-+2e-=3I-
B. 充电时,b是电源的正极
C. 充电时,外电路通过2mol电子,则有2molK+通过多孔离子传导膜
D. 由电池的电极反应可推出还原性:I->Br- >Cl-
【答案】A
【解析】
电解时,K+通过多孔离子传导膜,则连接b的电极为阴极,b为电源的负极,a极为正极,再根据原电池、电解池原理判断选项。
根据以上的分析可知,b为电源的负极,a极为正极。
A. 放电时,正极上I3-得电子生成I-,发生的电极反应式为I3-+2e-=3I-,选项A正确;
B. 充电时,b是电源的负极,连接阴极,选项B错误;
C. 充电时,外电路通过2mol电子,则有1mol锌离子得电子产生锌,故有2mol Cl-通过多孔离子传导膜,选项C错误;
D. 因电池的电极反应中只体现碘离子失电子能力,无法可推出还原性:I->Br- >Cl-,选项D错误。
答案选A。

 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案【题目】如表所示为元素周期表的一部分,参照元素①~⑨在表中的位置,请回答下列问题:
ⅠA | 0 | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ⑧ | ⑨ | ② | ③ | ||||
3 | ④ | ⑤ | ⑥ | ⑦ | ||||
(1)③、④、⑦的原子半径由大到小的顺序是________(用元素符号表示)。
(2)下列事实能说明元素②的非金属性比元素⑥的非金属性强的是________(填字母)。
A.②的单质与元素⑥的简单氢化物溶液反应,溶液变浑浊
B.在氧化还原反应中,1mol②单质比1mol⑥单质得电子多
C.②和⑥两元素的简单氢化物受热分解,前者的分解温度高
(3)①、②两种元素按原子个数之比为1∶1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式: ____。
(4)已知周期表中存在对角相似规则,如铍(Be)与铝化学性质相似,⑧的氧化物、氢氧化物也有两性,写出⑧的氢氧化物与④的最高价氧化物的水化物反应的化学方程式:________。
(5)已知W+X=Y+Z(反应需要加热),W、X、Y、Z分别是由①②⑨三种元素形成的四种10电子粒子(W、X为离子,Y、Z为分子),写出该离子方程式___________