题目内容
【题目】下列有关实验原理或实验操作正确的是
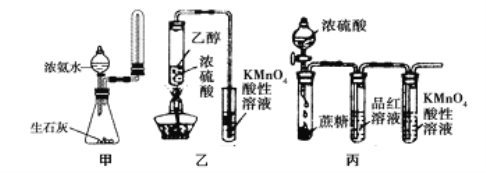
A. 实验室用图甲所示装置制取少量氨气
B. 为使100mL0.5mol/L的NaNO3溶液物质的量浓度变为1mol/L,可将原溶液加热蒸发掉50mL水
C. 利用图乙装置,可制取乙烯并验证其易被酸性KMnO4溶液氧化
D. 利用图丙装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
【答案】D
【解析】
A.气体收集装置不能密封;
B.100mL溶液蒸发掉50g水,剩余溶液体积未知,不能计算物质的量浓度;
C.挥发出来的乙醇也能够使酸性高锰酸钾溶液褪色,干扰了检验结果;
D.浓硫酸使蔗糖变黑,然后C与浓硫酸反应生成二氧化硫,二氧化硫能够漂白品红溶液,还能够与高锰酸钾发生氧化还原反应。
A.收集氨气的试管不能密封,否则无法收集氨气,故A错误;
B.蒸发掉50mL水后,剩余溶液未告诉密度,无法计算溶液的体积,则无法计算所得溶液的浓度,故B错误;
C.乙醇易挥发,挥发出的乙醇干扰了乙烯的检验,应该先用水除去乙醇,故C错误;
D.浓硫酸使蔗糖变黑,可知浓硫酸的脱水性,然后C与浓硫酸反应生成二氧化硫,二氧化硫能够使品红溶液褪色,证明二氧化硫检验漂白性;二氧化硫与高锰酸钾发生氧化还原反应,高锰酸钾褪色可知二氧化硫具有还原性,故D正确。
故选D。

【题目】“中和滴定”原理在实际生产生活中应用广泛。用I2O5可定量测定CO的含量,该反应原理为5CO+I2O5![]() 5CO2+I2。其实验步骤如下:
5CO2+I2。其实验步骤如下:
①取250 mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管中在170 ℃下充分反应;
②用水一乙醇液充分溶解产物I2,配制100 mL溶液;
③量取步骤②中溶液25.00 mL于锥形瓶中,然后用0.01 mol·L-1的Na2S2O3标准溶液滴定。消耗标准Na2S2O3溶液的体积如表所示。
第一次 | 第二次 | 第三次 | |
滴定前读数/mL | 2.10 | 2.50 | 1.40 |
滴定后读数/mL | 22.00 | 22.50 | 21.50 |
(1)步骤②中配制100 mL待测溶液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和____________________。
(2)Na2S2O3标准液应装在__________(填字母)中。

(3)指示剂应选用__________,判断达到滴定终点的现象是____________________________________。
(4)气体样品中CO的体积分数为__________(已知:气体样品中其他成分不与I2O5反应:2Na2S2O3+I2=2NaI+Na2S4O6)
(5)下列操作会造成所测CO的体积分数偏大的是__________(填字母)。
a.滴定终点俯视读数
b.锥形瓶用待测溶液润洗
c.滴定前有气泡,滴定后没有气泡
d.配制100 mL待测溶液时,有少量溅出