题目内容
【题目】NA表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠广泛应用于治金、染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。下列有关说法正确的是
Na2S+2CO2↑。下列有关说法正确的是
A. 1L.0.25mol/L.Na2SO4溶液中含有的氧原子数目为NA
B. 1L.0.1mol/LNa2S溶液中含有的阴离子数目小于0.1NA
C. 生成1mol还原产物时转移电子数为8NA
D. 通常状况下,11.2L.CO2中含有的共价键数目为2NA
【答案】C
【解析】
解答本类题目要审清选项中涉及的以下几个方面:①要审清所求粒子的种类,如分子、原子、离子、质子、中子、电子等,②涉及物质的体积时要审清物质的状态和温度、压强,③涉及中子数和化学键的计算,要审清相关物质的结构和特殊物质的摩尔质量,④涉及化学反应要明确相关反应的特点和电子转移;⑤涉及溶液中的微粒要关注电离和水解;⑥要注意审清运算公式。
A项、溶剂水分子中也含有氧原子,故无法计算1L0.25mol/LNa2SO4溶液中含有的氧原子数目,故A错误;
B项、Na2S溶液中S2-水解:S2-+H2O![]() HS-+OH-,导致阴离子总数增多,则阴离子数目大于0.1NA,故B错误;
HS-+OH-,导致阴离子总数增多,则阴离子数目大于0.1NA,故B错误;
C项、由方程式可知反应的还原产物为硫化钠,生成1mol硫化钠时转移电子数为1mol×[6-(-2)]=8mol,个数为8NA,故C正确;
D项、通常状况下,气体摩尔体积大于22.4L/mol,11.2LCO2的物质的量小于0.5 mol,所含有的共价键数目小于2NA,故D错误。
故选C。

【题目】为检验溶液中是否含有Cl-,某同学采用向溶液中先加HNO3,再加AgNO3,溶液的实验方案,若有白色沉淀生成,则证明有Cl-。对此结论,有人提出了质疑,设计了如下探究性实验。
实验一:向Na2SO4溶液中滴加AgNO3溶液
编号 | Na2SO4溶液 | AgNO3溶液 | 现象 | ||
体积/mL | 浓度/(mol·L-1) | 体积/滴 | 浓度/(mol·L-1) | ||
① | 1 | l | 3 | 2 | 出现大量白色沉淀 |
② | 1 | 1 | 3 | 0.5 | 出现少量白色沉淀 |
③ | 1 | 1 | 3 | 0.1 | 有些许浑浊 |
④ | 1 | 1 | 3 | 0.0l | 无明显变化 |
(1)实验一中产生沉淀的离子方程式为______。
(2)学生设计了如下表格,对实验一内容进行理论计算,请帮他完成表格。(表中不要留空格)。
[25℃时Ksp(Ag2SO4)=1.2×10-5,Ksp(AgCl)=1.8×10-10]
编号 | AgNO3浓度/(mol·L-1) | 稀释后Ag+浓度/(mol·L-1) | 混合液中SO42-的最小理论检出浓度/(mol·L-1) |
① | 2 | 0.2 | 0.0003 |
② | 0.5 | _______ | 0.0048 |
③ | 0.1 | 0.0l | 0.12 |
④ | _______ | 0.001 | _________ |
若向lmL某溶液中加入3滴0.1mol/LAgNO3溶液,分析上面数据,判断下列说法正确的是__ (填字母序号)。
A.混合液中c(SO42-)=0.1mol/L时不会产生Ag2SO4沉淀
B.混合液中c(SO42-)=1mol/L时不会产生Ag2SO4沉淀
C.无论SO42-浓度大小都会产生Ag2SO4沉淀
D.若使用0.01 mol/LAgNO3溶液,可基本排除SO42-对Cl-检验构成的干扰
(3)将实验一中编号③中的理论计算结果与现象对照,发现理论上大部分Ag+应该形成沉淀,这与“有些许浑浊”的现象相矛盾。为探究真相,在实验一的基础上继续设计了以下实验。
实验二:
编号 | AgNO3溶液 浓度/(mol·L-1) | 现象 | 向沉淀中滴加硝酸后的现象 |
① | 2 | 出现大量白色沉淀 | 滴加稀硝酸,沉淀大量溶解;改加浓硝酸,沉淀较快消失 |
② | 0.5 | 出现少量白色沉淀 | 滴加稀硝酸,沉淀基本消失 |
对于Ag2SO4溶于硝酸的原因提出了如下假设,请完成假设一。(已知:H2SO4=H++HSO4-、HSO4-![]() H++SO42-;假设二可能的原因是NO3-与Ag+形成配位化合物)
H++SO42-;假设二可能的原因是NO3-与Ag+形成配位化合物)
假设一:_____________。
假设二:NO3-对Ag2SO4溶解起作用。
(4)从下列限选试剂中选择适当试剂并设计实验方案,分别验证假设一和假设二是否成立。请写出实验步骤和结论。(限选试剂:Ag2SO4固体、浓HNO3、NaNO3饱和溶液、CaSO4固体)
________________
(5)通过(4)的实验,若证实假设一成立,请用平衡理论解释Ag2SO4溶解的原因_________
【题目】二碳化学的研究在工业生产中具有重要意义。
(1)在一定温度和压强下,已知:
化学键 | C—H | C—O | O—H | C===O | O===O | C—C |
键能/(kJ·mol-1) | 414 | 326 | 464 | 728 | 498 | 332 |
①CH3CH2OH(g)+1/2O2(g)![]() CH3CHO(g)+H2O(g) ΔH1=________。
CH3CHO(g)+H2O(g) ΔH1=________。
②若反应2CH3CHO(g)+O2(g)![]() 2CH3COOH(g)可自发进行,则CH3CH2OH(g)+O2(g)
2CH3COOH(g)可自发进行,则CH3CH2OH(g)+O2(g)![]() CH3COOH(g)+H2O(g) ΔH2________(填“>”“<”或“=”)0。
CH3COOH(g)+H2O(g) ΔH2________(填“>”“<”或“=”)0。
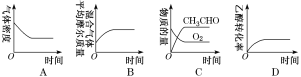
(2)将一定量的CH3CH2OH和O2充入恒温、恒压密闭容器中,发生反应2CH3CH2OH(g)+O2(g)![]() 2CH3CHO(g)+2H2O(g)至平衡状态。下列图象不合理的是________(填字母)。
2CH3CHO(g)+2H2O(g)至平衡状态。下列图象不合理的是________(填字母)。
(3)已知:25 ℃,Ka(CH3COOH)=1.75×10-5,Kb(NH3·H2O)=1.75×10-5,![]() ≈1.3,lg 1.3≈0.1。
≈1.3,lg 1.3≈0.1。
①25 ℃,0.1 mol·L-1CH3COOH溶液的pH=______;将0.1 mol·L-1CH3COOH溶液与0.1 mol·L-1的氨水等体积混合,所得溶液中离子浓度大小关系为_______________________________。
②25 ℃,0.2 mol·L-1NH4Cl溶液中NH4+水解反应的平衡常数Kh=________。(保留2位有效数字)
③25 ℃,向0.1 mol·L-1氨水中加入少量NH4Cl固体,NH3·H2O![]() NH4++OH-的电离平衡________(填“正向”“逆向”或“不”)移动;请用氨水和某种铵盐(其他试剂与用品自选),设计一个实验证明NH3·H2O是弱电解质____________________________________。
NH4++OH-的电离平衡________(填“正向”“逆向”或“不”)移动;请用氨水和某种铵盐(其他试剂与用品自选),设计一个实验证明NH3·H2O是弱电解质____________________________________。