题目内容
4.根据下列6种符号回答问题:①1H ②2 H ③3 H ④14C ⑤14N ⑥16O(1)共有6种核素,属于4种元素.
(2)互为同位素的是①②③.(填序号,下同)
(3)质量数相等的是④⑤,中子数相等的是④⑥.
分析 (1)质子数和中子数只要其一不相同就属于不同核素;元素的种类由质子数决定,质子数不同,元素的种类就不同;
(2)质子数相同,而中子数不同的原子,互称为同位素;
(3)原子符号左上角的数字为质量数;中子数=质量数-质子数.
解答 解:(1)①1H ②2 H ③3 H ④14C ⑤14N ⑥16O 分别为一种核素,共6种:①1H ②2 H ③3 H 都属于氢元素,④14C 属于碳元素,⑤14N 属于氮元素,⑥16O属于氧元素,一共有4种元素;
故答案为:6;4;
(2)其中:①1H ②2 H ③3 H 都属于氢元素,质子数相同,而中子数不同互为同位素;
故答案为:①②③;
(3)原子符号左上角的数字为质量数,则质量数相等的是④14C和 ⑤14N;④14C 中中子数=14-6=8,⑥16O 的中子数=16-8=8,所以二者中子数相同;
故答案为:④⑤;④⑥.
点评 本题主要考查了核数的种类、元素的种类、同位素的概念以及核外电子数的计算,难度不大,掌握概念即可完成.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
14.下列说法中,错误的是( )
| A. | 化学反应必然伴随着能量的变化 | |
| B. | 能量变化是化学反应的基本特征之一 | |
| C. | 化学变化的能量变化主要是由化学键的变化引起的 | |
| D. | 化学反应中能量变化的大小与反应物的状态和物质的量无关 |
15.一位患者镶了两颗假牙,其中一颗是黄金的,另一颗是不锈钢的.自镶上假牙后,他时感头疼,心情烦躁,多次治疗未见好转.如果你是医生,下列方法不能治疗其疾病的是( )
| A. | 将两颗假牙都做成黄金的 | B. | 将两颗假牙都做成不锈钢的 | ||
| C. | 将金假牙改为铝质假牙 | D. | 将两颗假牙都做成特殊树脂的 |
12.某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol•L-1 FeCl2溶液,实验记录如表(a、b、c代表电压值):
(1)用KSCN溶液检验出溶液中含Fe3+,看到的现象是溶液变红.
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化.写出Cl2氧化Fe2+的离子方程式:Cl2+2Fe2+═2Cl-+2Fe3+.
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电.原因是Fe2+具有还原性.
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证.控制变量,做对照实验继续探究:电解pH=1的NaCl溶液,记录如表:
①NaCl溶液的浓度应是0.2 mol•L-1.
②Ⅳ中检验Cl2的实验方法:取少量阳极附近的溶液,滴在淀粉碘化钾试纸上,试纸变蓝色.
③与Ⅱ对比,得出的结论:通过控制电压,证实了产生Fe3+的两种原因都成立;通过控制电压,验证了放电顺序是:Fe2+>Cl-(填“>”或“<”)
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化.写出Cl2氧化Fe2+的离子方程式:Cl2+2Fe2+═2Cl-+2Fe3+.
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电.原因是Fe2+具有还原性.
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证.控制变量,做对照实验继续探究:电解pH=1的NaCl溶液,记录如表:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
②Ⅳ中检验Cl2的实验方法:取少量阳极附近的溶液,滴在淀粉碘化钾试纸上,试纸变蓝色.
③与Ⅱ对比,得出的结论:通过控制电压,证实了产生Fe3+的两种原因都成立;通过控制电压,验证了放电顺序是:Fe2+>Cl-(填“>”或“<”)
19.已知一定温度时:N2(g)+3H2 (g)?2NH3(g).当生成2molNH3时,放出热量为92kJ,在相同温度和压强下,向密闭容器中通入1mol N2和3mol H2,达到平衡时放出热量为Q.则下列关系式中正确的是( )
| A. | Q=92 kJ | B. | Q<92 kJ | C. | Q>92 kJ | D. | Q=194kJ |
9.“酸化”是实验中经常采用的方法,下列酸化过程正确的是( )
| A. | 提高高锰酸钾的氧化能力,用盐酸酸化 | |
| B. | 抑制Fe2+的水解,用稀硝酸酸化 | |
| C. | 检验某氯代烷烃中含氯元素,加碱溶液加热后用稀硝酸酸化,再加硝酸银溶液检验 | |
| D. | 确认某溶液中含有SO42-时,先加入盐酸酸化,再加氯化钡溶液检验 |
16.碘硫化学循环原理如图1所示.
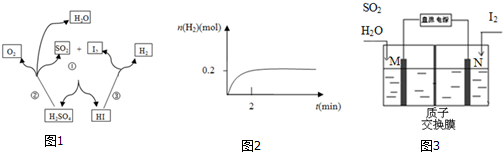
(1)写出反应③的化学方程式2HI$\stackrel{△}{?}$H2+I2,一定温度下,向2L密闭容器中加入2mol HI(g),测得n (H2)随时间的变化如图2所示,则该温度下该反应的平衡常数K=$\frac{1}{64}$.
(2)写出反应①的化学方程式I2+SO2+2H2O=2HI+H2SO4,其中SO2体现的是还原性.
(3)综合①②③三个反应,可看出该化学循环是为了制备某种能源气体,该气体的化学式是H2.
(4)氧缺位铁酸铜(CuFe2O4-δ)是反应②的良好的催化剂.实验室用如下方法制得:
Ⅰ.在Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液,加热
Ⅱ.调节pH并连续搅拌24小时
Ⅲ.过滤、干燥获得铁酸铜(CuFe2O4)
Ⅳ.在氮气保护下、1223K时煅烧CuFe2O4,得到CuFe2O3.86
①写出制备得到CuFe2O4的化学方程式2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O
②研究发现:
计算CuFe2O3.86中Fe3+与Fe2+的质量百分含量之比为43:7.
(5)由于该循环中H2SO4与HI发生副反应造成反应器堵塞,因此有科学家用如图3所示原理进行反应.写出阳极的电极反应式SO2+2H2O-2e-=4H++SO42-.请用文字说明在N极能够获得所需物质的原因是M极附近产生的H+通过质子交换膜移动到N极附近,与I2失电子后得到的I-形成HI溶液.

(1)写出反应③的化学方程式2HI$\stackrel{△}{?}$H2+I2,一定温度下,向2L密闭容器中加入2mol HI(g),测得n (H2)随时间的变化如图2所示,则该温度下该反应的平衡常数K=$\frac{1}{64}$.
(2)写出反应①的化学方程式I2+SO2+2H2O=2HI+H2SO4,其中SO2体现的是还原性.
(3)综合①②③三个反应,可看出该化学循环是为了制备某种能源气体,该气体的化学式是H2.
(4)氧缺位铁酸铜(CuFe2O4-δ)是反应②的良好的催化剂.实验室用如下方法制得:
Ⅰ.在Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液,加热
Ⅱ.调节pH并连续搅拌24小时
Ⅲ.过滤、干燥获得铁酸铜(CuFe2O4)
Ⅳ.在氮气保护下、1223K时煅烧CuFe2O4,得到CuFe2O3.86
①写出制备得到CuFe2O4的化学方程式2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O
②研究发现:
| 温度 | 元素存在形式 |
| 1200-1350K | Fe3+部分转变为Fe2+ |
(5)由于该循环中H2SO4与HI发生副反应造成反应器堵塞,因此有科学家用如图3所示原理进行反应.写出阳极的电极反应式SO2+2H2O-2e-=4H++SO42-.请用文字说明在N极能够获得所需物质的原因是M极附近产生的H+通过质子交换膜移动到N极附近,与I2失电子后得到的I-形成HI溶液.
13.某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00mL,大理石用量为10.00g.
请完成以下实验设计表,并在实验目的一栏中填空:
请完成以下实验设计表,并在实验目的一栏中填空:
| 实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响;(Ⅱ)实验①和③探究温度对反应速率的影响;(Ⅲ)实验①和④探究大理石规格(粗、细)对反应速率的影响. |
| ② | ||||
| ③ | ||||
| ④ |
