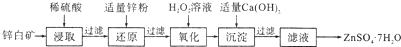
题目内容
1.亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业.它在碱性环境中稳定存在.工业设计生产NaClO2的主要流程如图1所示.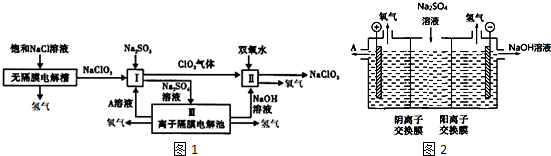
另附III离子交换膜电解池示意图图2.
(1)写出无隔膜电解槽阳极反应的电极反应式:Cl-+3H2O-6e-=ClO3-+6H+
(2)由离子交换膜电解池示意图分析A的化学式是H2SO4
(3)Ⅱ中反应的离子方程式是2ClO2+H2O2+2OH-=2ClO2-+O2+2H2O
(4)设备Ⅲ在通电电解前,检验其溶液中主要阴离子的方法、步骤、现象是取少量Ⅲ中溶液少许于试管中,先加入足量稀盐酸,无沉淀生成,再加入BaCl2溶液,产生白色沉淀,证明含有SO42-.
分析 根据工艺流程图用有离子隔膜的电解槽电解Na2SO4溶液,可知气体a为O2,该极为阳极,OH-放电,c(H+)增大,SO42-移向该极,所以A为硫酸溶液,Ⅰ中氯酸钠、亚硫酸钠和稀硫酸反应生成二氧化氯和硫酸钠,Ⅱ中发生二氧化氯与双氧水在碱性条件下反应生成NaClO2和氧气;
(1)根据工艺流程图无隔膜电解槽阳极发生氧化反应生成氯酸根离子;
(2)解槽电解Na2SO4溶液,可知气体a为O2,该极为阳极,OH-放电,c(H+)增大,SO42-移向该极,所以A为硫酸溶液;
(3)Ⅱ中发生二氧化氯与双氧水在碱性条件下反应生成NaClO2和氧气,根据电子得失守恒分析配平;
(4)设备Ⅲ在通电电解前,检验其溶液中主要阴离子是硫酸根离子,SO42-的检验方法:用稀盐酸和氯化钡溶液检验.
解答 解:(1)根据工艺流程图无隔膜电解槽阳极发生氧化反应生成氯酸根离子,所以电极反应式为Cl-+3H2O-6e-=ClO3-+6H+,故答案为:Cl-+3H2O-6e-=ClO3-+6H+; (2)解槽电解Na2SO4溶液,可知气体a为O2,该极为阳极,OH-放电,c(H+)增大,SO42-移向该极,所以A为硫酸溶液,故答案为:H2SO4;
(3)Ⅱ中发生二氧化氯与双氧水在碱性条件下反应生成NaClO2和氧气,所以方程式为:2ClO2+H2O2+2OH-=2ClO2-+O2+2H2O,故答案为:2ClO2+H2O2+2OH-=2ClO2-+O2+2H2O;
(4)电解前Ⅲ中阴离子为SO42-,SO42-的检验方法:取少量Ⅲ中溶液少许于试管中,先加入足量稀盐酸,无沉淀生成,再加入BaCl2溶液,产生白色沉淀,证明含有SO42-;
故答案为:取少量Ⅲ中溶液少许于试管中,先加入足量稀盐酸,无沉淀生成,再加入BaCl2溶液,产生白色沉淀,证明含有SO42-.
点评 本题以亚氯酸钠(NaClO2)的生产流程为情境,主要考查电解原理、氧化还原反应、离子方程式的书写、SO42-的检验等知识点,主要通过工艺流程考查学生分析问题、解决问题的能力,题目难度中等.

| A. | NO(NO2):通过装有水的洗气装置 | |
| B. | Cu粉(铁粉):加足量稀硝酸,过滤 | |
| C. | NH3(H2O):通过装有浓硫酸的洗气装置 | |
| D. | KCl(CaCl2):加适量Na2CO3溶液,过滤 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化.写出Cl2氧化Fe2+的离子方程式:Cl2+2Fe2+═2Cl-+2Fe3+.
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电.原因是Fe2+具有还原性.
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证.控制变量,做对照实验继续探究:电解pH=1的NaCl溶液,记录如表:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
②Ⅳ中检验Cl2的实验方法:取少量阳极附近的溶液,滴在淀粉碘化钾试纸上,试纸变蓝色.
③与Ⅱ对比,得出的结论:通过控制电压,证实了产生Fe3+的两种原因都成立;通过控制电压,验证了放电顺序是:Fe2+>Cl-(填“>”或“<”)
| A. | 提高高锰酸钾的氧化能力,用盐酸酸化 | |
| B. | 抑制Fe2+的水解,用稀硝酸酸化 | |
| C. | 检验某氯代烷烃中含氯元素,加碱溶液加热后用稀硝酸酸化,再加硝酸银溶液检验 | |
| D. | 确认某溶液中含有SO42-时,先加入盐酸酸化,再加氯化钡溶液检验 |
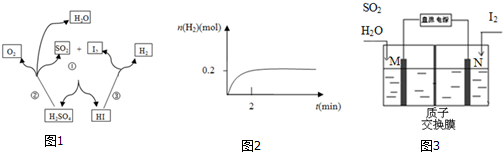
(1)写出反应③的化学方程式2HI$\stackrel{△}{?}$H2+I2,一定温度下,向2L密闭容器中加入2mol HI(g),测得n (H2)随时间的变化如图2所示,则该温度下该反应的平衡常数K=$\frac{1}{64}$.
(2)写出反应①的化学方程式I2+SO2+2H2O=2HI+H2SO4,其中SO2体现的是还原性.
(3)综合①②③三个反应,可看出该化学循环是为了制备某种能源气体,该气体的化学式是H2.
(4)氧缺位铁酸铜(CuFe2O4-δ)是反应②的良好的催化剂.实验室用如下方法制得:
Ⅰ.在Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液,加热
Ⅱ.调节pH并连续搅拌24小时
Ⅲ.过滤、干燥获得铁酸铜(CuFe2O4)
Ⅳ.在氮气保护下、1223K时煅烧CuFe2O4,得到CuFe2O3.86
①写出制备得到CuFe2O4的化学方程式2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O
②研究发现:
| 温度 | 元素存在形式 |
| 1200-1350K | Fe3+部分转变为Fe2+ |
(5)由于该循环中H2SO4与HI发生副反应造成反应器堵塞,因此有科学家用如图3所示原理进行反应.写出阳极的电极反应式SO2+2H2O-2e-=4H++SO42-.请用文字说明在N极能够获得所需物质的原因是M极附近产生的H+通过质子交换膜移动到N极附近,与I2失电子后得到的I-形成HI溶液.
请完成以下实验设计表,并在实验目的一栏中填空:
| 实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响;(Ⅱ)实验①和③探究温度对反应速率的影响;(Ⅲ)实验①和④探究大理石规格(粗、细)对反应速率的影响. |
| ② | ||||
| ③ | ||||
| ④ |
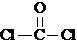 ,COCl2分子内含有( )
,COCl2分子内含有( )| A. | 4个σ键 | B. | 2个σ键、2个π键 | C. | 2个σ键、1个π键 | D. | 3个σ键、1个π键 |
| A. | 周期表是按各元素的相对原子质量递增的顺序从左到右排列的 | |
| B. | 元素周期表共有16个族,也就是16个纵行 | |
| C. | 同周期元素的电子层数相同 | |
| D. | 每一周期的元素都是从碱金属开始,以稀有气体结束 |