题目内容
15.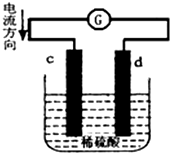 将锌片和铜片同时插入100mL 稀硫酸中,组成的原电池装置如图所示(c、d为两个电极,电池工作过程中溶液体积不变).下列有关判断不正确的是( )
将锌片和铜片同时插入100mL 稀硫酸中,组成的原电池装置如图所示(c、d为两个电极,电池工作过程中溶液体积不变).下列有关判断不正确的是( )| A. | 当电路中通过2 mol 电子时,d 极可以生成22.4 L H2 | |
| B. | 当电路中通过0.1 mol 电子时,溶液中c(Zn2+)=0.5 mol•L-1 | |
| C. | c为负极,发生氧化反应 | |
| D. | 电池工作完成后,溶液中SO42-浓度基本不变 |
分析 由电流方向可知,c为负极,d为正极,因锌比铜活泼,则锌为负极,发生氧化反应,电极方程式为Zn-2e-═Zn2+,铜为正极,发生还原反应,电极方程式为2H++2e-═H2↑,以此解答该题.
解答 解:由电流方向可知,c为负极,d为正极,
A.d为正极,发生还原反应,电极方程式为2H++2e-═H2↑,但未指明标况下,则无法计算体积,故A错误;
B.c为负极,发生氧化反应,电极方程式为Zn-2e-═Zn2+,所以当电路中通过0.1 mol 电子时,溶液中c(Zn2+)=$\frac{0.05mol}{0.1L}$=0.5 mol•L-1,故B正确;
C.c为负极,发生氧化反应,故C正确;
D.SO42-不参加电极反应,则溶液中SO42-浓度基本不变,故D正确.
故选A.
点评 本题考查了原电池的反应原理的应用,为高频考点,侧重于学生的分析能力,注意把握电子流向、电极判断,溶液pH的变化判断,题目难度不大.

练习册系列答案
相关题目
6.将几滴KSCN(SCN-是“类卤离子”)溶液加入酸性的含有Fe3+的溶液中,溶液变成红色,将该红色溶液分为两份,①一份中加入适量KMnO4溶液,红色褪去;②向另一份中通入SO2,红色也褪去.下列说法不正确的是( )
| A. | ①红色褪去的原因是KMnO4将SCN-氧化,使Fe(SCN)3消失 | |
| B. | ②红色褪去的原因是SO2将Fe3+还原为Fe2+ | |
| C. | ②红色褪去的原因是SO2将SCN-还原 | |
| D. | SCN-在适当条件下可失去电子被氧化剂氧化为(SCN)2 |
3.W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X、W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色.下列判断正确的是( )
| A. | 离子的氧化性:Y>Z | B. | 氢化物的沸点:X<W | ||
| C. | X、W最高正价相同 | D. | 原子及离子半径:Z>Y>X |
10.硫化氢与二氧化硫反应生成了32g单质硫,则氧化产物和还原产物的质量之比是( )
| A. | 1:2 | B. | 1:3 | C. | 1:1 | D. | 2:1 |
20.对下列事实的解释错误的是( )
| A. | Cu与浓硝酸反应生成NO2而与稀硝酸反应生成NO,说明浓度不同氧化性不同 | |
| B. | 在蔗糖中加入浓硫酸后出现黑色物质,说明浓硫酸具有脱水性 | |
| C. | 浓硝酸保存在棕色试剂瓶中,说明浓硝酸不稳定 | |
| D. | 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 |
7.镤-239原子核内有148个中子.现有A元素的一种同位素,比镤-239的原子核内少54个质子和100个中子,则A元素在周期表中的位置是( )
| A. | 第3周期第ⅠA族 | B. | 第4周期第ⅠA族 | C. | 第5周期第ⅠA族 | D. | 第3周期第ⅡA族 |
5.下列有关碱金属的说法中,不正确的是( )
| A. | IA族元素都是碱金属元素 | B. | K的还原性强于Na | ||
| C. | Na和Na+灼烧时都能使火焰呈黄色 | D. | Na在空气中燃烧时生成Na2O2 |
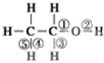 乙醇分子中化学键如图:
乙醇分子中化学键如图: 实验室制硝基苯的装置见如图
实验室制硝基苯的装置见如图 .
.