题目内容
7.镤-239原子核内有148个中子.现有A元素的一种同位素,比镤-239的原子核内少54个质子和100个中子,则A元素在周期表中的位置是( )| A. | 第3周期第ⅠA族 | B. | 第4周期第ⅠA族 | C. | 第5周期第ⅠA族 | D. | 第3周期第ⅡA族 |
分析 根据质量数=质子数+中子数,计算出该同位素镤-239的质子数,再计算出A元素的质子数,根据质子数确定其在元素周期表中的物质.用质子数分别减去各周期所含有的元素种数.
解答 解:同位素镤-239的质子数为239-148=91,
所以A元素的质子数为91-54=37.
37-2-8-8-18=1
所以A位于第5周期第IA族.
故选:C.
点评 考查结构与位置关系,难度不大.已知元素的原子序数确定元素在周期表中位置的方法:1、根据每周期容纳元素的种数:第一至第六周期每周期容纳元素的种数分别为2、8、8、18、18、32,用元素的原子序数减去每一周期容纳元素种数,当余数小于某周期容纳元素种数时,元素处于该周期,如114号元素:114-2-8-8-18-18-32=28<32(第七周期排满容纳元素种数),所以114号元素应位于第七周期.2、记住118号元素在周期表中的位置:第七周期0族元素(元素周期表的第18纵行,与元素原子序数的后两位数字相同),故114号元素应位于周期表的第七周期第十四纵行,即第IVA主族.3、根据核外电子排布判断.

练习册系列答案
相关题目
17.A、B、C、D、E、F、G为由七种短周期元素构成的粒子,它们都有10个电子,其结构特点如下表:
其中,B的离子半径大于E的离子半径;D是常温常压下能使湿润红色石蕊试纸变蓝色的气体;C常用作F的检验(加热).请填写下列空白:
(1)A粒子的结构示意图 ,G的化学式是CH4.
,G的化学式是CH4.
(2)比较BC和EC2的碱性强弱BC>EC2(填<、>、=).
(3)F与C反应生成D的离子方程式NH4++OH-=NH3.H2O.
| 粒子代号 | A | B | C | D | E | F | G |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
(1)A粒子的结构示意图
 ,G的化学式是CH4.
,G的化学式是CH4.(2)比较BC和EC2的碱性强弱BC>EC2(填<、>、=).
(3)F与C反应生成D的离子方程式NH4++OH-=NH3.H2O.
15.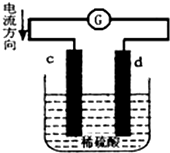 将锌片和铜片同时插入100mL 稀硫酸中,组成的原电池装置如图所示(c、d为两个电极,电池工作过程中溶液体积不变).下列有关判断不正确的是( )
将锌片和铜片同时插入100mL 稀硫酸中,组成的原电池装置如图所示(c、d为两个电极,电池工作过程中溶液体积不变).下列有关判断不正确的是( )
 将锌片和铜片同时插入100mL 稀硫酸中,组成的原电池装置如图所示(c、d为两个电极,电池工作过程中溶液体积不变).下列有关判断不正确的是( )
将锌片和铜片同时插入100mL 稀硫酸中,组成的原电池装置如图所示(c、d为两个电极,电池工作过程中溶液体积不变).下列有关判断不正确的是( )| A. | 当电路中通过2 mol 电子时,d 极可以生成22.4 L H2 | |
| B. | 当电路中通过0.1 mol 电子时,溶液中c(Zn2+)=0.5 mol•L-1 | |
| C. | c为负极,发生氧化反应 | |
| D. | 电池工作完成后,溶液中SO42-浓度基本不变 |
2.广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别离解成两部分,然后两两重新组合成新的物质.根据上述观点,说法不正确的是( )
| A. | BaO2的水解产物是Ba(OH)2和H2O2 | B. | PCl3的水解产物是HClO和H3PO4 | ||
| C. | A14C3的水解产物是Al(OH)3和CH4 | D. | CH3COCl的水解产物是两种酸 |
12.下列有关能量的叙述不正确的是( )
| A. | 化石能源物质内部贮存着大量的能量 | |
| B. | 绿色植物进行光合作用时,将太阳能转化为化学能贮存起来 | |
| C. | 物质的化学能可以在不同条件下转化为热能、电能为人类所利用 | |
| D. | 吸热反应中由于反应物的总能量小于生成物的总能量,因而没有利用价值 |
19.A原子的结构示意图为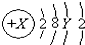 .则下列说法正确的是( )
.则下列说法正确的是( )
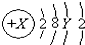 .则下列说法正确的是( )
.则下列说法正确的是( )| A. | 3p能级上的电子数只能为6 | |
| B. | 3d能级上的电子数可能为1-10 | |
| C. | Y可只能为3-8 | |
| D. | 2p,3p能级上的电子数可以相同,也可以不同 |
16.某研究小组为了探究“铁与水蒸气”的反应的产物,进行了下列实验:用如图1所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒高温下不与水和铁反应).

(1)如何检查该装置的气密性:将C处导气管末端浸入水槽中,加热A处圆底烧瓶,导管末端出现气泡,停止加热后导管末端出现一段水柱
(2)写出铁与水蒸气反应的化学方程式3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2
(3)验证固体产物中铁元素的价态
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;1mol/L CuSO4、3mol/L H2SO4、3mol/L HNO3、30%H2O2、0.01mol/L KMnO4、20%KSCN、蒸馏水.
在答题卡上按下表的格式写出实验步骤、预期现象与结论.
步骤1中加入足量1mol/L CuSO4溶液的作用是除去反应后固体中可能未反应完的铁粉,以免影响后续实验的结果分析.
(4)固体产物中铁元素的质量分数的测定可采用图2的流程.其中步骤①是向溶液中加入锌粉至黄色刚好消失;步骤②用0.010mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液平均为v mL.(已知5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O)其中加入锌粉的目的是将Fe3+还原为Fe2+.实验测得ag样品中固体产物铁元素的质量分数为$\frac{250×5×56g/mol×0.010mol/L×V×1{0}^{-3}L}{25a}$×100%_(只列计算表达式).

(1)如何检查该装置的气密性:将C处导气管末端浸入水槽中,加热A处圆底烧瓶,导管末端出现气泡,停止加热后导管末端出现一段水柱
(2)写出铁与水蒸气反应的化学方程式3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2
(3)验证固体产物中铁元素的价态
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;1mol/L CuSO4、3mol/L H2SO4、3mol/L HNO3、30%H2O2、0.01mol/L KMnO4、20%KSCN、蒸馏水.
在答题卡上按下表的格式写出实验步骤、预期现象与结论.
| 实验步骤 | 预期现象与结论 | |
| 步骤1 | 取反应后干燥的固体ag于试管中,加入足量的1mol/L CuSO4溶液,充分振荡,经固液分离、洗涤后,再向固体中滴加足量的3mol/LH2SO4,振荡溶解,过滤后将滤液配成250mL溶液,待用. | - |
| 步骤2 | 取少量步骤1中滤液于试管中,滴加1~2滴20%KSCN | 溶液变红色,则固体产物含+3价铁 |
| 步骤3 | 取少量步骤1中滤液于试管中,滴加1~2滴0.01mol/LKMnO4 | 溶液紫色褪去,则固体产物含+2价铁 |
(4)固体产物中铁元素的质量分数的测定可采用图2的流程.其中步骤①是向溶液中加入锌粉至黄色刚好消失;步骤②用0.010mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液平均为v mL.(已知5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O)其中加入锌粉的目的是将Fe3+还原为Fe2+.实验测得ag样品中固体产物铁元素的质量分数为$\frac{250×5×56g/mol×0.010mol/L×V×1{0}^{-3}L}{25a}$×100%_(只列计算表达式).
17.北京时间9月25日21时10分04秒,我国航天事业又迎来一个历史性时刻,我国自行研制的神舟七号载人飞船在酒泉卫星发射中心发射升空,于28日下午回到美丽的地球.“神舟”七号汇集了大量最新科技,发射火箭的常规推进剂为四氧化氮和偏二甲肼(C2H8N2),5.00g C2H8N2完全燃烧可放出212.5kJ热量.下列叙述正确的是( )
| A. | 燃烧不一定有氧气参加,也不一定是放热反应 | |
| B. | 火箭点火后,喷出的红色火焰是金属的焰色反应产生的 | |
| C. | 火箭燃料燃烧主要是将化学能转变为热能和光能,可能对环境产生污染 | |
| D. | 偏二甲肼燃烧的热化学方程式是:C2H8N2(g)+2N2O4(g)═2N2(g)+2CO2(g)+4H2O(g);△H=-2550kJ/mol |