题目内容
3.W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X、W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色.下列判断正确的是( )| A. | 离子的氧化性:Y>Z | B. | 氢化物的沸点:X<W | ||
| C. | X、W最高正价相同 | D. | 原子及离子半径:Z>Y>X |
分析 W、X、Y、Z均为短周期元素,W的原子最外层电子数与核外电子总数之比为7:17,应为Cl元素;X与W同主族,则X为F元素;Y的原子序数是W和X的原子序数之和的一半,Y原子序数应为$\frac{17+9}{2}$=13,为Al元素;含Z元素的物质焰色反应为黄色,应为Na元素,结合元素化合物的性质以及元素周期律的递变规律解答.
解答 解:W、X、Y、Z均为短周期元素,W的原子最外层电子数与核外电子总数之比为7:17,应为Cl元素;X与W同主族,则X为F元素;Y的原子序数是W和X的原子序数之和的一半,Y原子序数应为$\frac{17+9}{2}$=13,为Al元素;含Z元素的物质焰色反应为黄色,应为Na元素.
A.金属性Al<Na,故离子氧化性Al3+>Na+,故A正确;
B.HF分子之间存氢键,沸点高于HCl,故B错误;
C.F元素没有最高正化合价+7,故C错误;
D.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径Na>Al>F,电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径F->Na+>Al3+,故D错误,
故选A.
点评 本题考查结构性质位置关系应用,推断元素是解题的关键,注意掌握核外电子排布与元素周期律,难度中等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
13.已知反应2HBr(g)?Br2(g)+H2(g),在四种不同的条件下进行,Br2、H2起始的浓度为0,反应物HBr的浓度(mol/L)随反应时间(min)的变化情况如下表:
下列说法正确的是( )
| 实验序号 | 实验温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.5 | 0.5 | 0.5 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
| A. | 从上表数据分析,2HBr?Br2+H2正反应为放热反应 | |
| B. | 实验2中HBr的初始浓度C2=1.0 mol/L | |
| C. | 实验3的反应速率小于实验1的反应速率 | |
| D. | 实验4一定使用了催化剂 |
14.已知:
CH3CH2CH2CH3(g)+6.5O2(g)=4CO2(g)+5H2O(l)△H=-2878kJ/mol
(CH3)2CHCH3(g)+6.5O2(g)=4CO2(g)+5H2O(l)△H=-2869kJ/mol
下列说法正确的是( )
CH3CH2CH2CH3(g)+6.5O2(g)=4CO2(g)+5H2O(l)△H=-2878kJ/mol
(CH3)2CHCH3(g)+6.5O2(g)=4CO2(g)+5H2O(l)△H=-2869kJ/mol
下列说法正确的是( )
| A. | 正丁烷的稳定性大于异丁烷 | |
| B. | 异丁烷分子中的碳氢键比正丁烷的多 | |
| C. | 等物质的量的正丁烷能量大于异丁烷能量 | |
| D. | 异丁烷转化为正丁烷的过程是一个放热过程 |
11.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸.当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐.
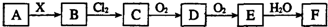
下列说法中不正确的是( )
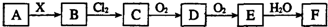
下列说法中不正确的是( )
| A. | 当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4 | |
| B. | 当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3 | |
| C. | B和Cl2的反应是氧化还原反应 | |
| D. | 当X是强酸时,C在常温下是气态单质 |
8.将12g金属粉末混合物,加入足量稀硫酸中,至无气泡产生为止,共收集到氢气11.2L(标准状况下),此混合物可能是( )
| A. | Zn和Cu | B. | Al和Fe | C. | Ag和Zn | D. | Mg和Fe |
15.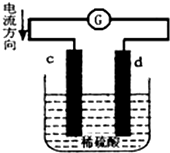 将锌片和铜片同时插入100mL 稀硫酸中,组成的原电池装置如图所示(c、d为两个电极,电池工作过程中溶液体积不变).下列有关判断不正确的是( )
将锌片和铜片同时插入100mL 稀硫酸中,组成的原电池装置如图所示(c、d为两个电极,电池工作过程中溶液体积不变).下列有关判断不正确的是( )
 将锌片和铜片同时插入100mL 稀硫酸中,组成的原电池装置如图所示(c、d为两个电极,电池工作过程中溶液体积不变).下列有关判断不正确的是( )
将锌片和铜片同时插入100mL 稀硫酸中,组成的原电池装置如图所示(c、d为两个电极,电池工作过程中溶液体积不变).下列有关判断不正确的是( )| A. | 当电路中通过2 mol 电子时,d 极可以生成22.4 L H2 | |
| B. | 当电路中通过0.1 mol 电子时,溶液中c(Zn2+)=0.5 mol•L-1 | |
| C. | c为负极,发生氧化反应 | |
| D. | 电池工作完成后,溶液中SO42-浓度基本不变 |
12.下列有关能量的叙述不正确的是( )
| A. | 化石能源物质内部贮存着大量的能量 | |
| B. | 绿色植物进行光合作用时,将太阳能转化为化学能贮存起来 | |
| C. | 物质的化学能可以在不同条件下转化为热能、电能为人类所利用 | |
| D. | 吸热反应中由于反应物的总能量小于生成物的总能量,因而没有利用价值 |
13.下列说法正确的是( )
| A. | 氯化钠和盐酸溶于水都发生电离,克服粒子间作用力的类型相同 | |
| B. | 金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子 | |
| C. | HI的分子质量大于HF,所以HI的沸点高于HF | |
| D. | 由IA族和VIA族元素形成的原子个数比为l:1,离子个数比为2:l的化合物是含有共价键的离子化合物 |