题目内容
19.随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.(1)处理NOx的一种方法是利用甲烷催化还原NOx.已知:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为CH4(g)+2 NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1.
(2)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g)?N2(g)+2CO2(g);△H<0.若在一定温度下,将2mol NO、1mol CO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图1所示,计算该反应的化学平衡常数:K=$\frac{5}{144}$.若升高温度则平衡常数将变小(变大、不变、变小).若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将不移动
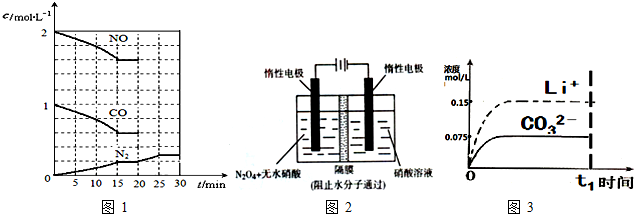 (填“向左”、“向右”或“不”).
(填“向左”、“向右”或“不”).20min时,若改变反应条件,导致N2浓度发生如图3所示的变化,则改变的条件可能是②(填序号).
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
(3)肼(N2H4)用亚硝酸氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977.写出肼与亚硝酸反应的化学方程式N2H4+HNO2═HN3+2H2O.
(4)如图2所示装置可用于制备N2O5,则生成N2O5的那一极电极为阳极(阴、阳极),反应式为N2O4-2e-+2HNO3═2N2O5+2H+.
(5)已知某温度下Li2CO3的Ksp为1.68×10-3,将适量Li2CO3固体溶于100mL水中至刚好饱和,饱和Li2CO3溶液中c(Li+)=0.15mol•L-1.c(CO32-)=0.075mol•L-1若t1时刻在上述体系中加入100mL0.125mol•L-1 Na2CO3 溶液,列式计算说明是否有沉淀产生.
(6)请画出t1时刻后Li+和CO32-浓度随时间变化的关系图(用虚线表示Li+,实线表示CO32-).
分析 (1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
由盖斯定律,(①+②)÷2可得:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g),反应热也进行相应的计算;
(2)计算平衡时二氧化碳的浓度,将各组分的平衡浓度代入平衡常数表达式K=$\frac{c({N}_{2})×{c}^{2}(C{O}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$计算;
正反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数变小;
判断此时的浓度商与平衡常数关系,进而判断平衡移动方向;
20min时,改变反应条件瞬间N2浓度不变,而后N2浓度增大,结合外界条件对平衡影响分析解答;
(3)肼(N2H4)用亚硝酸氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,则分子中N原子数目为$\frac{43×0.977}{14}$=3,H原子数目为$\frac{43-14×3}{1}$=1,故该氢化物为HN3,还有水生成,配平书写方程式;
(4)阴极是氢离子放电,阳极应是N2O4氧化得到N2O5,在硝酸条件下有氢离子生成;
(5)计算混合时溶液中c(Li+)、c(CO32-),再计算浓度积,与溶度积比较判断;
(6)结合(5)计算可知t1时刻瞬间c(Li+)、c(CO32-),若没有沉淀析出,则从t1时刻起为水平线,若有沉淀析出,再根据溶度积计算平衡时c(Li+)、c(CO32-),画出变化图象.
解答 解:(1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
由盖斯定律(①+②)÷2得到CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1,
故答案为:CH4(g)+2 NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1;
(2)由方程式可知,平衡时二氧化碳的浓度为0.2mol/L×2=0.4mol/L,平衡常数K=$\frac{c({N}_{2})×{c}^{2}(C{O}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$=$\frac{0.2×0.{4}^{2}}{1.{6}^{2}×0.{6}^{2}}$=$\frac{5}{144}$;
正反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数变小;
若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,则浓度商=$\frac{(0.2+0.6)×0.{4}^{2}}{1.{6}^{2}×(0.6+0.6)^{2}}$=$\frac{5}{144}$,等于平衡常数,故平衡不移动,
20min时,改变反应条件瞬间N2浓度不变,而后N2浓度增大:
①加入催化剂,平衡不移动,但不到不变,故错误;
②降低温度,瞬间氮气浓度不变,平衡向正反应移动,氮气浓度增大,故正确;
③缩小容器体积,瞬间氮气浓度增大,平衡向向正反应方向移动,但浓度继续增大,故错误;
④增加CO2的量,瞬间氮气浓度不变,平衡向逆反应移动,氮气浓度减小,故错误,
故答案为:$\frac{5}{144}$;变小;不;②;
(3)肼(N2H4)用亚硝酸氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,则分子中N原子数目为$\frac{43×0.977}{14}$=3,H原子数目为$\frac{43-14×3}{1}$=1,故该氢化物为HN3,还有水生成,反应方程式为:N2H4+HNO2═HN3+2H2O,
故答案为:N2H4+HNO2═HN3+2H2O;
(4)阴极是氢离子放电,阳极应是N2O4氧化得到N2O5,在硝酸条件下有氢离子生成,阳极电极反应式为:N2O4-2e-+2HNO3═2N2O5+2H+,
故答案为:阳极;N2O4-2e-+2HNO3═2N2O5+2H+;
(5)若t1时刻在上述体系中加入100mL0.125mol•L-1 Na2CO3溶液,此时c(Li+)=0.075mol/L,c(CO32-)=$\frac{0.075mol+0.125mol}{2}$=0.1mol/L,则c(CO32-)×c2(Li+)=5.6×10-4<1.68×10-3,则没有沉淀生成,
答:混合时c(Li+)=0.075mol/l、c(CO32-)=0.1mol/L,而c(CO32-)•c2(Li+)=5.6×10-4<Ksp,所以无沉淀;
(6)由(5)中分析可知,t1时刻c(Li+)=0.075mol/l、c(CO32-)=0.1mol/l,没有沉淀析出,t1时刻后Li+和CO32-浓度画出图象为: ,
,
故答案为: .
.
点评 本题考查盖斯定律的应用、化学平衡常数计算及应用、化学平衡影响因素、电解池、溶度积有关计算及溶解平衡等,需要学生具备扎实的基础与灵活运用能力,难度中等.

| A. | 小于100mL | B. | 等于100mL | C. | 大于100mL | D. | 等于100/ρmL |
| A. | Mg2+?SO42-?K+?Cl- | B. | K+?Cl-?NO-3?Cu2+ | ||
| C. | Na+?SO2-4?H+?NO-3 | D. | K+?CO32-?Cl-?Na+ |
| A. | 0.20 mol/L Ag+ | B. | 0.20 mol/L Al3+ | C. | 0.20 mol/L Cu2+ | D. | 0.20 mol/L Mg2+ |
| A. | 热稳定性:H2Se>H2S>H2O | B. | 原子半径:Se>Cl>S | ||
| C. | 酸性:H2SeO4<H2SO4<HClO4 | D. | 还原性:S2->Se2->Br- |
| A. | CH3COO-、SO42-、K+、Mg2+ | B. | H+、MnO4-、K+、Cl- | ||
| C. | H+、NO3-、Na+、SO42- | D. | OH-、NO3-、Na+、NH4+ |
| A. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照条件下和点燃条件下的△H不同 | |
| B. | 常温下反应2A(s)+B(g)═2C(g)+D(g)不能自发进行,则反应的焓变一定大于零 | |
| C. | 需要加热的化学反应,生成物的总能量一定高于反应物的总能量 | |
| D. | 等质量的硫粉分别在空气、氧气中燃烧,放出热量多的是硫粉在氧气燃烧 |