题目内容
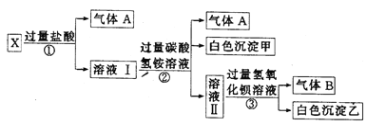
【题目】为探究某固体化合物X(仅含四种元素)的组成和性质,设计并完成如下实验。请回答:

(1)蓝色溶液中的金属阳离子是________。
(2)黑色化合物→砖红色化合物的化学方程式是________________________。
(3)X的化学式是________。
【答案】Cu2+ 4CuO![]() 2Cu2O+O2↑ Cu3(OH)2(CO3)2或Cu(OH)2·2CuCO3
2Cu2O+O2↑ Cu3(OH)2(CO3)2或Cu(OH)2·2CuCO3
【解析】
根据流程中信息可知黑色化合物为CuO,砖红色化合物为Cu2O,红色金属单质为Cu,蓝色溶液为CuSO4溶液;n(H2O)=![]() =0.01 mol,黑色化合物n(CuO)=
=0.01 mol,黑色化合物n(CuO)=![]() =0.03 mol,无色无味气体n(CO2)= n(CaCO3)=
=0.03 mol,无色无味气体n(CO2)= n(CaCO3)=![]() =0.02 mol,故可根据各元素推知分子式Cu3C2H2O8,则推断出X为Cu3(OH)2(CO3)2或Cu(OH)2·2CuCO3,据此分析。
=0.02 mol,故可根据各元素推知分子式Cu3C2H2O8,则推断出X为Cu3(OH)2(CO3)2或Cu(OH)2·2CuCO3,据此分析。
根据流程中信息可知黑色化合物为CuO,砖红色化合物为Cu2O,红色金属单质为Cu,蓝色溶液为CuSO4溶液;n(H2O)=![]() =0.01 mol,n(H)=0.02mol,黑色化合物n(CuO)=
=0.01 mol,n(H)=0.02mol,黑色化合物n(CuO)=![]() =0.03 mol,无色无味气体n(CO2)= n(CaCO3)=
=0.03 mol,无色无味气体n(CO2)= n(CaCO3)=![]() =0.02 mol,故n(O)=0.04+0.03+0.01=0.08mol,可根据各元素推知分子式Cu3C2H2O8,则推断出X为Cu3(OH)2(CO3)2或Cu(OH)2·2CuCO3。
=0.02 mol,故n(O)=0.04+0.03+0.01=0.08mol,可根据各元素推知分子式Cu3C2H2O8,则推断出X为Cu3(OH)2(CO3)2或Cu(OH)2·2CuCO3。
(1)蓝色溶液为CuSO4溶液,含有的金属阳离子是Cu2+;
(2)黑色化合物→砖红色化合物,只能是CuO→Cu2O,反应的化学方程式是4CuO![]() 2Cu2O+O2↑;
2Cu2O+O2↑;
(3)X的化学式是Cu(OH)2·2CuCO3或Cu3(OH)2(CO3)2。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),进行反应,2SO2+O2![]() 2SO3,其起始物质的量及SO2的平衡转化率如下表所示。下列判断中正确的是
2SO3,其起始物质的量及SO2的平衡转化率如下表所示。下列判断中正确的是
甲 | 乙 | 丙 | 丁 | ||
密闭容器体积/L | 2 | 2 | 2 | 1 | |
起始物质的量 | n(SO2)/ mol | 0.40 | 0.80 | 0.80 | 0.40 |
n(O2)/ mol | 0.24 | 0.24 | 0.48 | 0.24 | |
SO2的平衡转化率% | 80 | α1 | α2 | α3 | |
A.甲中反应的平衡常数小于乙
B.该温度下,该反应的平衡常数K为400
C.SO2的平衡转化率:α1>α2=α3
D.容器中SO3的物质的量浓度:丙=丁<甲
【题目】甲醇既是重要的化工原料,又是电动公交车的清洁能源,利用水煤气在一定条件下含成甲醇,发生的反应为:![]() ?
?![]() 已知CO、
已知CO、![]() 、
、![]() 的燃烧热分别为283.0kJ/mol,285.8kJ/mol,726.5kJ/mol,则
的燃烧热分别为283.0kJ/mol,285.8kJ/mol,726.5kJ/mol,则![]() ______。
______。![]() 在一容积为2L的恒容密闭容器中加入
在一容积为2L的恒容密闭容器中加入![]() CO和
CO和![]()
![]() ,发生如下反应:CO
,发生如下反应:CO![]() ,实验测得
,实验测得![]() 和
和![]() 下,甲醇的物质的量随时间的变化如表所示,下列说法正确的是
下,甲醇的物质的量随时间的变化如表所示,下列说法正确的是
时间 | 10min | 20min | 30min | 40min | 50min | 60min |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
![]() 由上述数据可以判断:
由上述数据可以判断:![]() ______
______![]()
![]() 时,
时,![]() 的平均反应速率
的平均反应速率![]() ______。
______。![]() 该反应
该反应![]() 达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是______
达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是______![]() 选填编号
选填编号![]() 。
。
A 改用高效催化剂![]() 升高溫度
升高溫度![]() 缩小容器体积
缩小容器体积 ![]() 分离出甲醇
分离出甲醇 ![]() 增加CO的浓度
增加CO的浓度![]() 若保持
若保持![]() 不变,起始时加入CO、
不变,起始时加入CO、![]() 、
、![]() 的物质的量分别为amol、bmol、cmol,达到平衡时,仍与原平衡等效,则a、b、c应该满足的条件______。
的物质的量分别为amol、bmol、cmol,达到平衡时,仍与原平衡等效,则a、b、c应该满足的条件______。![]() 当反应在
当反应在![]() 达到20min时,控制体积不变,迅速将
达到20min时,控制体积不变,迅速将![]() ,
,![]() ,
,![]() 同时投入体系中,后在恒压条件下,反应在40min时达到平衡,请在图中画出20~40min内容器中
同时投入体系中,后在恒压条件下,反应在40min时达到平衡,请在图中画出20~40min内容器中![]() 浓度的变化趋势曲线:______
浓度的变化趋势曲线:______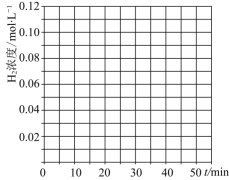
![]() 在以
在以![]() 为燃料的燃料电池中,电解质溶液为酸性,则负极的电极反应式为______;理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为______。
为燃料的燃料电池中,电解质溶液为酸性,则负极的电极反应式为______;理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为______。![]() 燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比
燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比![]()
【题目】目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题.
(1)向浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙![]() 粒子直径在1-100nm之间)。①向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入NH3,后通入CO2,制备纳米级碳酸钙的离子方程式为 ______ ②判断产品中是否含有纳米级碳酸钙的实验方法为 ______.
粒子直径在1-100nm之间)。①向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入NH3,后通入CO2,制备纳米级碳酸钙的离子方程式为 ______ ②判断产品中是否含有纳米级碳酸钙的实验方法为 ______.
(2)一定条件下,C(s)和H2O(g)反应,能生成CO2(g)和H2(g),将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生反应:C(s)+2H2O(g)![]() CO2(g)+2H2(g)其相关数据如下表所示:
CO2(g)+2H2(g)其相关数据如下表所示:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/mol | |
C(s) | H2O(g) | H2(g) | ||||
甲 | 2 |
| 2 | 4 |
| 8 |
乙 | 1 |
| 1 | 2 |
| 3 |
①T1℃时,该反应的平衡常数 ______
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度 ____![]() 填选项字母
填选项字母![]() .
.
A、=0.8mol·L-1 B、=1.4mol·L-1 C、<1.4mol·L-1 D、>1.4mol·L-1
③丙容器的容积为1L,T2℃时,起始充入amolCO2(g)和bmolH2(g),反应达到平衡时,测得CO2的转化率大于![]() 的转化率,则
的转化率,则![]() 的值需满足的条件为 ______;
的值需满足的条件为 ______;
④丁容器的容积为1L,![]() 时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是 ______
时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是 ______![]() 填选项字母
填选项字母![]() .
.
A 0.6mol、1.0mol、0.5mol、1.0mol
B 0.6mol、2.0mol、0mol、0mol
C 1.0mol、2.0mol、1.0mol、2.0mol
D 0.25mol、0.5mol、0.75mol、1.5mol
(3)CO2在一定条件下可转化为甲醚CH3OCH3用甲醚燃料电池做电源,用惰性电极电解饱和K2SO4溶液可制取H2SO4和KOH,实验装置如图所示
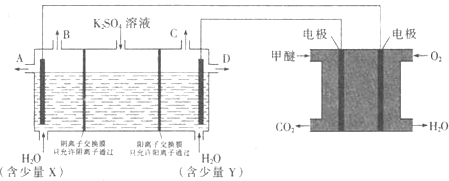
![]() 甲醚燃料电池的负极反应式为 ______
甲醚燃料电池的负极反应式为 ______
![]() 口导出的物质为 ______
口导出的物质为 ______![]() 填化学式
填化学式![]() .
.
![]() 若燃料电池通入CH3OCH3(g)的速率为0.1mol·L-1·min-1,2min时,理论上C口收集到标准状况下气体的体积为 ______.
若燃料电池通入CH3OCH3(g)的速率为0.1mol·L-1·min-1,2min时,理论上C口收集到标准状况下气体的体积为 ______.