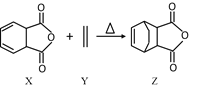
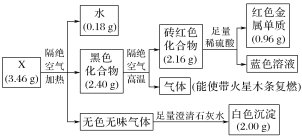
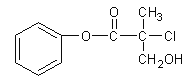
题目内容
【题目】目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题.
(1)向浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙![]() 粒子直径在1-100nm之间)。①向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入NH3,后通入CO2,制备纳米级碳酸钙的离子方程式为 ______ ②判断产品中是否含有纳米级碳酸钙的实验方法为 ______.
粒子直径在1-100nm之间)。①向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入NH3,后通入CO2,制备纳米级碳酸钙的离子方程式为 ______ ②判断产品中是否含有纳米级碳酸钙的实验方法为 ______.
(2)一定条件下,C(s)和H2O(g)反应,能生成CO2(g)和H2(g),将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生反应:C(s)+2H2O(g)![]() CO2(g)+2H2(g)其相关数据如下表所示:
CO2(g)+2H2(g)其相关数据如下表所示:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/mol | |
C(s) | H2O(g) | H2(g) | ||||
甲 | 2 |
| 2 | 4 |
| 8 |
乙 | 1 |
| 1 | 2 |
| 3 |
①T1℃时,该反应的平衡常数 ______
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度 ____![]() 填选项字母
填选项字母![]() .
.
A、=0.8mol·L-1 B、=1.4mol·L-1 C、<1.4mol·L-1 D、>1.4mol·L-1
③丙容器的容积为1L,T2℃时,起始充入amolCO2(g)和bmolH2(g),反应达到平衡时,测得CO2的转化率大于![]() 的转化率,则
的转化率,则![]() 的值需满足的条件为 ______;
的值需满足的条件为 ______;
④丁容器的容积为1L,![]() 时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是 ______
时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是 ______![]() 填选项字母
填选项字母![]() .
.
A 0.6mol、1.0mol、0.5mol、1.0mol
B 0.6mol、2.0mol、0mol、0mol
C 1.0mol、2.0mol、1.0mol、2.0mol
D 0.25mol、0.5mol、0.75mol、1.5mol
(3)CO2在一定条件下可转化为甲醚CH3OCH3用甲醚燃料电池做电源,用惰性电极电解饱和K2SO4溶液可制取H2SO4和KOH,实验装置如图所示
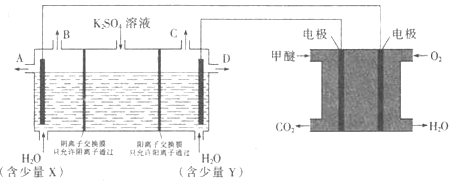
![]() 甲醚燃料电池的负极反应式为 ______
甲醚燃料电池的负极反应式为 ______
![]() 口导出的物质为 ______
口导出的物质为 ______![]() 填化学式
填化学式![]() .
.
![]() 若燃料电池通入CH3OCH3(g)的速率为0.1mol·L-1·min-1,2min时,理论上C口收集到标准状况下气体的体积为 ______.
若燃料电池通入CH3OCH3(g)的速率为0.1mol·L-1·min-1,2min时,理论上C口收集到标准状况下气体的体积为 ______.
【答案】Ca2++CO2+2NH3+H2O=CaCO3+2NH4+ 丁达尔效应 12.8 C ![]() AD CH3OCH3+3H2O-12e-=2CO2↑+12H+ H2SO4 26.88L
AD CH3OCH3+3H2O-12e-=2CO2↑+12H+ H2SO4 26.88L
【解析】
(1)①二氧化碳、氨气和氯化钙反应生成碳酸钙胶体与氯化铵;
②鉴别胶体的常用方法为丁达尔效应;
(2)①利用三段式计算平衡时各组分的物质的量,再根据平衡常数![]() 计算;
计算;
② 随反应进行,物质的浓度降低,反应速率较短,故前![]() 水的浓度变化量大于后
水的浓度变化量大于后![]() 水的浓度变化量,据此解答;
水的浓度变化量,据此解答;
③ 若![]() 与
与![]() 的物质的量之比等于化学计量数之比1:2,则二者转化率相等,
的物质的量之比等于化学计量数之比1:2,则二者转化率相等,![]() 的转化率大于
的转化率大于![]() 的转化率,则
的转化率,则![]() 与
与![]() 的物质的量之比小于1:2;
的物质的量之比小于1:2;
④ 反应前后气体的体积发生变化,恒温恒容下,改变初始各组分的物质的量,平衡时各气体的体积分数与甲容器完全相同,则为完全等效平衡,起始时固体的量碳的量减小会影响参加反应水的物质的量,故按化学计量数转化到左边,起始浓度相等,故满足![]() ,且
,且![]() :
:![]() :2;
:2;
(3)①甲醚发生氧化反应,在负极失去电子,由装置图可知,生成二氧化碳,根据守恒可知,同时生成氢离子;
②电解池左侧电极连接原电池的正极,发生氧化反应反应,水![]() 氢氧根
氢氧根![]() 在正极放电,结合离子交换膜可知,有生成硫酸生成与氧气生成;
在正极放电,结合离子交换膜可知,有生成硫酸生成与氧气生成;
③电解池右侧电极连接右侧负极,氢离子在正极放电,结合离子交换膜可知,有氢气、KOH生成,C口收集的气体为氢气,根据电子转移守恒计算氢气的体积。
(1)①浓![]() 溶液中通入
溶液中通入![]() 和
和![]() ,可以制得纳米级碳酸钙,离子反应方程式为Ca2++CO2+2NH3+H2O=CaCO3+2NH4+ ,
,可以制得纳米级碳酸钙,离子反应方程式为Ca2++CO2+2NH3+H2O=CaCO3+2NH4+ ,
故答案为:Ca2++CO2+2NH3+H2O=CaCO3+2NH4+ ;
②纳米级碳酸钙具有胶体的性质,而鉴别胶体的常用方法为丁达尔效应,所以要判断产品中是否含有纳米级碳酸钙的简单实验方法为丁达尔效应, /span>
故答案为:丁达尔效应;
(2)①由表中数据可知,平衡时氢气的物质的量为3.2mol,则:
C(s)+2H2O(g)![]() CO2(g)+2H2(g)
CO2(g)+2H2(g)
开始![]() : 24 0 0
: 24 0 0
转化![]() :
:![]()
![]()
![]()
![]()
平衡![]() :
:![]()
![]()
![]()
![]()
平衡常数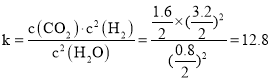 ,
,
故答案为:12.8;
② 3min内水的浓度变化量![]() 氢气的浓度变化量,
氢气的浓度变化量,![]() =1.2mol·L-1随反应进行,物质的浓度降低,反应速率较短,故前1.5min水的浓度变化量大于后1.5min水的浓度变化量,故反应进行到1.5min时,H2O(g)物质的量浓度小于
=1.2mol·L-1随反应进行,物质的浓度降低,反应速率较短,故前1.5min水的浓度变化量大于后1.5min水的浓度变化量,故反应进行到1.5min时,H2O(g)物质的量浓度小于![]() ,
,
故答案为:C;
![]() 若
若![]() 与
与![]() 的物质的量之比等于化学计量数之比1:2,则二者转化率相等,
的物质的量之比等于化学计量数之比1:2,则二者转化率相等,![]() 的转化率大于
的转化率大于![]() 的转化率,则
的转化率,则![]() 与
与![]() 的物质的量之比小于1:2,即
的物质的量之比小于1:2,即![]() :2,
:2,
故答案为:![]() :2;
:2;
![]() 反应前后气体的体积发生变化,恒温恒容下,改变初始各组分的物质的量,平衡时各气体的体积分数与甲容器完全相同,则为完全等效平衡,起始时固体的量碳的量减小会影响参加反应水的物质的量,按化学计量数转化到左边,起始浓度相等,故满足
反应前后气体的体积发生变化,恒温恒容下,改变初始各组分的物质的量,平衡时各气体的体积分数与甲容器完全相同,则为完全等效平衡,起始时固体的量碳的量减小会影响参加反应水的物质的量,按化学计量数转化到左边,起始浓度相等,故满足![]() ,且
,且![]() :
:![]() :2,
:2,
A.按化学计量数转化到左边,![]() 与
与![]() 恰好转化,则
恰好转化,则![]() ,
,![]() :
:![]() :
:![]() :
:![]() :2,故A正确;
:2,故A正确;
B.![]() ,
,![]() :
:![]() :
:![]() :
:![]() :2,故B错误;
:2,故B错误;
C.按化学计量数转化到左边,![]() 与
与![]() 恰好转化,则
恰好转化,则![]() ,故C错误;
,故C错误;
D.按化学计量数转化到左边,![]() 与
与![]() 恰好转化,则
恰好转化,则![]() ,
,![]() :
:![]() :
:![]() :2,故D正确,
:2,故D正确,
故答案为:AD;
![]() 甲醚发生氧化反应,在负极失去电子,由装置图可知,生成二氧化碳,根据守恒可知,同时生成氢离子,负极电极反应式为:
甲醚发生氧化反应,在负极失去电子,由装置图可知,生成二氧化碳,根据守恒可知,同时生成氢离子,负极电极反应式为:![]() ,
,
故答案为:![]() ;
;
![]() 电解池左侧电极连接原电池的正极,发生氧化反应反应,水
电解池左侧电极连接原电池的正极,发生氧化反应反应,水![]() 氢氧根
氢氧根![]() 在正极放电,结合离子交换膜可知,有生成硫酸生成与氧气生成,由图可知左侧A口导出的物质为液体,应是
在正极放电,结合离子交换膜可知,有生成硫酸生成与氧气生成,由图可知左侧A口导出的物质为液体,应是![]() ,
,
故答案为:![]() ;
;
![]() 电解池右侧电极连接右侧负极,氢离子在正极放电,结合离子交换膜可知,有氢气、KOH生成,C口收集的气体为氢气,反应的甲醚为
电解池右侧电极连接右侧负极,氢离子在正极放电,结合离子交换膜可知,有氢气、KOH生成,C口收集的气体为氢气,反应的甲醚为![]() ,根据电子转移守恒可知,生成氢气的物质的量
,根据电子转移守恒可知,生成氢气的物质的量![]() ,故生成氢气的体积
,故生成氢气的体积 ,
,
故答案为:![]() .
.

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:![]() 三氯化氮
三氯化氮![]() 是一种黄色、油状、具有刺激性气味的挥发性有毒液体,各原子均满足8电子稳定结构。其电子式是______。氯碱工业生产时,由于食盐水中通常含有少量
是一种黄色、油状、具有刺激性气味的挥发性有毒液体,各原子均满足8电子稳定结构。其电子式是______。氯碱工业生产时,由于食盐水中通常含有少量![]() ,而在阴极区与生成的氯气反应产生少量
,而在阴极区与生成的氯气反应产生少量![]() ,该反应的化学方程式为______。
,该反应的化学方程式为______。![]() 一定条件下,不同物质的量的
一定条件下,不同物质的量的![]() 与不同体积的
与不同体积的![]() 溶液充分反应放出的热量如下表所示:
溶液充分反应放出的热量如下表所示:
反应序号 | n | V | 放出的热量 |
1 |
|
| A |
2 |
|
| b |
该条件![]() 与NaOH 溶液反应生成
与NaOH 溶液反应生成![]() 的热化学反应方程式为______。
的热化学反应方程式为______。![]() 利用CO可以将NO转化为无害的
利用CO可以将NO转化为无害的 ,其反应为:
,其反应为:![]() ,向容积均为1L的甲,乙两个恒温
,向容积均为1L的甲,乙两个恒温![]() 温度分别为
温度分别为![]() 、
、![]() 容器中分别加入
容器中分别加入![]() 和
和![]() ,测得各容器中
,测得各容器中![]() 随反应时间t的变化情况如下表所示:
随反应时间t的变化情况如下表所示:
| 0 | 40 | 80 | 120 | 160 |
|
|
|
|
|
|
|
|
|
|
|
|
![]() 甲容器中,
甲容器中,![]() 内用NO的浓度变化表示的反应速率
内用NO的浓度变化表示的反应速率![]() ______。
______。![]() 该反应的
该反应的![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。
。![]() 甲容器反应达到平衡后,若容器内各物质的量均增加1倍,则平衡______
甲容器反应达到平衡后,若容器内各物质的量均增加1倍,则平衡______![]() 填“正向”、“逆向”或“不”
填“正向”、“逆向”或“不”![]() 移动。
移动。![]() 常温下,在
常温下,在![]() 溶液中,反应
溶液中,反应![]() 的平衡常数
的平衡常数![]() ______。
______。![]() 已知常温下,
已知常温下,![]() 的电离平衡常数
的电离平衡常数![]() ,
,![]() 的电离平衡常数
的电离平衡常数![]() ,
,![]()
![]() 在酸性电解质溶液中,以惰性材料作电极,将
在酸性电解质溶液中,以惰性材料作电极,将![]() 转化为丙烯的原理如图所示
转化为丙烯的原理如图所示
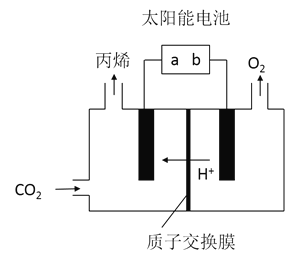
![]() 太阳能电池的负极是______
太阳能电池的负极是______![]() 填“a”或“b”
填“a”或“b”![]()
![]() 生成丙烯的电极反应式是______。
生成丙烯的电极反应式是______。
【题目】用试纸检验气体性质是一种重要的实验方法.如表所示的实验中![]() 可加热
可加热![]() ,下列试纸的选用、现象、对应结论都正确的一项是
,下列试纸的选用、现象、对应结论都正确的一项是![]()
序号 | 试剂B | 湿润的试纸A | 结论 |
A | 碘水 | 淀粉试纸变蓝 | 碘具有氧化性 |
B | 浓氨水、生石灰 | 蓝色石蕊试纸变红 | 氨气为碱性气体 |
C |
| 品红试纸褪色 |
|
D | Cu、浓硝酸 | 淀粉KI试纸变蓝 |
|
A.AB.BC.CD.D