题目内容
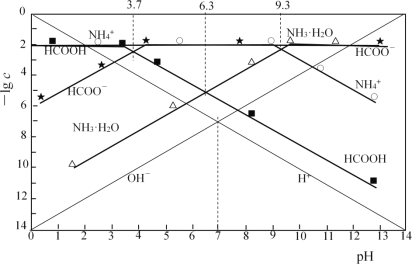
【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),进行反应,2SO2+O2![]() 2SO3,其起始物质的量及SO2的平衡转化率如下表所示。下列判断中正确的是
2SO3,其起始物质的量及SO2的平衡转化率如下表所示。下列判断中正确的是
甲 | 乙 | 丙 | 丁 | ||
密闭容器体积/L | 2 | 2 | 2 | 1 | |
起始物质的量 | n(SO2)/ mol | 0.40 | 0.80 | 0.80 | 0.40 |
n(O2)/ mol | 0.24 | 0.24 | 0.48 | 0.24 | |
SO2的平衡转化率% | 80 | α1 | α2 | α3 | |
A.甲中反应的平衡常数小于乙
B.该温度下,该反应的平衡常数K为400
C.SO2的平衡转化率:α1>α2=α3
D.容器中SO3的物质的量浓度:丙=丁<甲
【答案】B
【解析】
A.温度相同时,该反应的平衡常数不变,则甲、乙中反应的平衡常数相等,故A错误;
B. 2SO2(g)+O2(g)2SO3(g),
开始(mol) 0.4 0.24 0
转化(mol) 0.320.16 0.32
平衡(mol) 0.08 0.080.32
平衡浓度(mol/L)0.04 0.040.16
所以该温度下该反应的平衡常数值为:K=![]() =400,故B正确;C.由甲、乙可知,氧气的浓度相同,二氧化硫的浓度增大会促进氧气的转化,二氧化硫转化率减小,丙体积为2L,丁体积为1L,起始量分别为0.8,0.48;0.40,0.24,丙和丁达到的平衡相同,丙实验氧气物质的量增大,氧气转化率增大;则二氧化硫转化率,α1<α2=α3,故C错误;D.体积相同,丙中的起始浓度为甲的2倍,压强增大,平衡正向移动,则丙中转化率增大,即丙中c(SO3)大于甲中c(SO3)的2倍,丙体积为2L,丁体积为1L,起始量分别为0.8,0.48;0.40,0.24,丙和丁达到的平衡相同,三氧化硫浓度相同,丙=丁>甲,故D错误;故选B。
=400,故B正确;C.由甲、乙可知,氧气的浓度相同,二氧化硫的浓度增大会促进氧气的转化,二氧化硫转化率减小,丙体积为2L,丁体积为1L,起始量分别为0.8,0.48;0.40,0.24,丙和丁达到的平衡相同,丙实验氧气物质的量增大,氧气转化率增大;则二氧化硫转化率,α1<α2=α3,故C错误;D.体积相同,丙中的起始浓度为甲的2倍,压强增大,平衡正向移动,则丙中转化率增大,即丙中c(SO3)大于甲中c(SO3)的2倍,丙体积为2L,丁体积为1L,起始量分别为0.8,0.48;0.40,0.24,丙和丁达到的平衡相同,三氧化硫浓度相同,丙=丁>甲,故D错误;故选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目