题目内容
【题目】某无色溶液X,由Na+、Mg2+、Ba2+、Al3+、AlO2-、MnO![]() 、CO
、CO![]() 、SO
、SO![]() 中的若干种离子组成,取溶液进行如下连续实验:
中的若干种离子组成,取溶液进行如下连续实验:
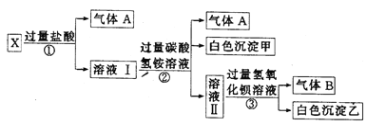
(1)气体A的成分是_______(填电子式),气体B的成分是_______(填结构式)
(2)X溶液中一定不存在的离子是______________。
(3)写出步骤①中发生反应的所有离子方程式:________________。
(4)写出步骤②中形成白色沉淀的离子方程式:________________。
(5)通过上述实验,溶液X中不能确定是否存在的离子是______________;只要设计一个简单的后续实验就可以确定该离子是否存在,该方法是__________________。
【答案】![]()
 Mg2+、Ba2+、Al3+、MnO4- CO32-+2H+=H2O+CO2↑ AlO2-+4H+=Al3++2H2O,Al3++3HCO3-=Al(OH)3↓+3CO2↑ SO42- 在沉淀乙中加入足量盐酸,若白色沉淀能完全溶解,则X中不存在SO42-;若不完全溶解,则X中存在SO42-
Mg2+、Ba2+、Al3+、MnO4- CO32-+2H+=H2O+CO2↑ AlO2-+4H+=Al3++2H2O,Al3++3HCO3-=Al(OH)3↓+3CO2↑ SO42- 在沉淀乙中加入足量盐酸,若白色沉淀能完全溶解,则X中不存在SO42-;若不完全溶解,则X中存在SO42-
【解析】
溶液呈无色,则一定不含MnO4-,溶液X中加入过量盐酸,有气体A生成,并得到溶液I,说明原溶液中含有CO32-,气体A为CO2,CO32-与Mg2+、Ba2+、Al3+不能大量共存,则原溶液一定不含Mg2+、Ba2+、Al3+;反应①中加入盐酸过量,反应②中加入过量的NH4HCO3,产生的气体为CO2,白色沉淀甲只能为Al(OH)3,则X溶液中一定含有AlO2-,碳酸氢铵过量,与过量Ba(OH)2反应并加热,得到气体为NH3,白色沉淀乙一定含有BaCO3,可能含有BaSO4,所以溶液X中一定不存在的离子有:MnO4-、Mg2+、Ba2+、Al3+,不能确定原溶液中是否含有SO42-,根据溶液电中性原则可知含有Na+,溶液X中一定含有CO32-、AlO2-、Na+,以此分析解答。
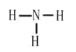
(1)由分析可知,气体A为CO2,CO2为共价化合物,碳原子和每个氧原子之间有两个共用电子对,电子式为:![]() ;气体B为NH3,氮原子和每个氢原子之间有一个共用电子对,结构式为:
;气体B为NH3,氮原子和每个氢原子之间有一个共用电子对,结构式为: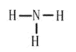 ;
;
(2)由分析可知,X溶液中一定不存在的离子是Mg2+、Ba2+、Al3+、MnO4-;
(3)步骤①X溶液中加入过量盐酸,碳酸根与盐酸反应生成二氧化碳气体,离子方程式为:CO32-+2H+=H2O+CO2↑;
(4)由分析可知X中有AlO2-,与盐酸反应生成Al3+,铝离子和碳酸氢根离子水解相互促进生成二氧化碳气体和氢氧化铝白色沉淀,有关的离子方程式:AlO2-+4H+=Al3++2H2O,Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(5)由分析可知,不能确定溶液X中是否含有SO42-,要验证SO42-的存在,根据BaCO3不溶于水但能溶于酸、BaSO4既不溶于水也不溶于酸的性质,可在沉淀乙中加入足量盐酸,若白色沉淀能完全溶解,则X中不存在SO42-;若不完全溶解,则X中存在SO4-,答案为:SO42-;在沉淀乙中加入足量盐酸,若白色沉淀能完全溶解,则X中不存在SO42-;若不完全溶解,则X中存在SO4-。

【题目】用试纸检验气体性质是一种重要的实验方法.如表所示的实验中![]() 可加热
可加热![]() ,下列试纸的选用、现象、对应结论都正确的一项是
,下列试纸的选用、现象、对应结论都正确的一项是![]()
序号 | 试剂B | 湿润的试纸A | 结论 |
A | 碘水 | 淀粉试纸变蓝 | 碘具有氧化性 |
B | 浓氨水、生石灰 | 蓝色石蕊试纸变红 | 氨气为碱性气体 |
C |
| 品红试纸褪色 |
|
D | Cu、浓硝酸 | 淀粉KI试纸变蓝 |
|
A.AB.BC.CD.D