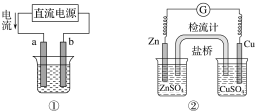
ћвƒњƒЏ»Ё
°Њћвƒњ°њћЉ°Ґµ™ «÷Ў“™µƒЈ«љр ф‘™ЋЎ£ђ‘Џ…ъ≤ъ°Ґ…ъїо÷–”–єгЈЇµƒ”¶”√°£
(1)“—÷™÷≤ќпєвЇѕ„ч”√ЈҐ…ъµƒЈі”¶»зѕ¬£Ї6CO2(g)£Ђ6H2O(l) ![]() C6H12O6(s)£Ђ6O2(g) °чH£љ£Ђ669.62 kJmol£≠1Є√Јі”¶іпµљїѓ—І∆љЇвЇу£ђ»фЄƒ±дѕ¬Ѕ–ћхЉю£ђCO2„™їѓ¬ ‘ціуµƒ «__________°£
C6H12O6(s)£Ђ6O2(g) °чH£љ£Ђ669.62 kJmol£≠1Є√Јі”¶іпµљїѓ—І∆љЇвЇу£ђ»фЄƒ±дѕ¬Ѕ–ћхЉю£ђCO2„™їѓ¬ ‘ціуµƒ «__________°£
a£Ѓ‘ціуCO2µƒ≈®ґ» b£Ѓ»°„я“ї∞лC6H12O6
c£ЃЉ”»ліяїѓЉЅ d£Ѓ µ±…эЄяќ¬ґ»
(2)N2O5µƒЈ÷љвЈі”¶2N2O5(g)![]() 4NO2(g) + O2(g)£ђ”… µ—й≤вµ√‘Џ67°ж ±N2O5µƒ≈®ґ»Ћж ±Љдµƒ±дїѓ»зѕ¬£Ї
4NO2(g) + O2(g)£ђ”… µ—й≤вµ√‘Џ67°ж ±N2O5µƒ≈®ґ»Ћж ±Љдµƒ±дїѓ»зѕ¬£Ї
±Љд/min | 0 | 1 | 2 | 3 | 4 | 5 |
c(N2O5) /(molL©Б1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
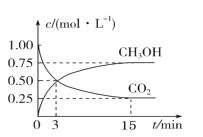
Љ∆Ћг‘Џ0°Ђ2min ±ґќ£ђїѓ—ІЈі”¶Ћў¬ v(NO2) £љ________molL-1min-1°£
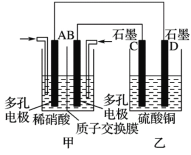
(3)»фљЂNO2”лO2Ќ®»лЉ„÷–…иЉ∆≥…»зЌЉЋщ Њ„∞÷√£ђDµзЉЂ…ѕ”–Їм…Ђќп÷ ќц≥ц£ђ‘тAµзЉЂі¶Ќ®»лµƒ∆шћеќ™_________£®ћоїѓ—І љ£©£їAµзЉЂµƒµзЉЂЈі”¶ љќ™_______________________£ђ“їґќ ±ЉдЇу£ђ»ф““÷––иЉ”0.2 mol Cu(OH)2 є»№“ЇЄі‘≠£ђ‘т„™“∆µƒµз„”µƒќп÷ µƒЅњќ™ _____________°£
(4)»фљЂCOЇЌNO∞і≤їЌђ±»јэЌґ»л“ї√№±’»Ё∆ч÷–ЈҐ…ъЈі”¶£Ї2CO(g)£Ђ2NO(g)![]() N2(g)£Ђ2CO2(g)°°¶§H£љ£≠759.8 kJ°§mol£≠1£ђЈі”¶іпµљ∆љЇв ±£ђN2µƒћеїэЈ÷ эЋжn(CO)/n(NO)µƒ±дїѓ«ъѕя»зѕ¬ЌЉ
N2(g)£Ђ2CO2(g)°°¶§H£љ£≠759.8 kJ°§mol£≠1£ђЈі”¶іпµљ∆љЇв ±£ђN2µƒћеїэЈ÷ эЋжn(CO)/n(NO)µƒ±дїѓ«ъѕя»зѕ¬ЌЉ
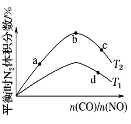
Ґўbµг ±£ђ∆љЇвћеѕµ÷–C°ҐN‘≠„”Єц э÷Ѓ±»љ”љь________________£ї
ҐЏa°Ґb°Ґc»эµгCOµƒ„™їѓ¬ і”іуµљ–°µƒЋ≥–тќ™____________£їa°Ґc°Ґd»эµгµƒ∆љЇв≥£ эі”іуµљ–°µƒЋ≥–тќ™__________________°£
Ґџ»ф![]() £љ0.8£ђЈі”¶іп∆љЇв ±£ђN2µƒћеїэЈ÷ эќ™20%£ђ‘тCOµƒ„™їѓ¬ ќ™___________°£
£љ0.8£ђЈі”¶іп∆љЇв ±£ђN2µƒћеїэЈ÷ эќ™20%£ђ‘тCOµƒ„™їѓ¬ ќ™___________°£
°Њір∞Є°њd 0.5 NO2 NO2£≠e-£ЂH2O=NO3-£Ђ2H£Ђ 0.8 mol 1°√1 a>b>c a£љc>d 75%
°Њљвќц°њ
£®1£©a£Ѓ‘ціуCO2µƒ≈®ґ»£ђЈі”¶ќп≈®ґ»‘ціу£ђ∆љЇвѕт’эЈі”¶Јљѕт“∆ґѓ£ђµЂCO2µƒ„™їѓ¬ Љх–°£ї
b£ЃЄƒ±дєћћеµƒЅњ£ђ≤їƒ№Єƒ±дЈі”¶Ћў¬ £ђ≤їƒ№Єƒ±д∆љЇвµƒ“∆ґѓЈљѕт£ї
c£ЃіяїѓЉЅƒ№љµµЌЈі”¶µƒїоїѓƒ№£ђЉ”њмЈі”¶Ћў¬ £ђ≤їƒ№Єƒ±д∆љЇвµƒ“∆ґѓЈљѕт£ї
d£ЃЄ√Јі”¶ќ™ќь»»Јі”¶£ђ µ±…эЄяќ¬ґ»£ђ∆љЇвѕт’эЈі”¶Јљѕт“∆ґѓ£ї
£®2£©”…їѓ—ІЈі”¶Ћў¬ ÷Ѓ±»µ»”Џїѓ—ІЉ∆Ѕњ э÷Ѓ±»њ…µ√v(NO2) £љ2v(N2O5)£ї
£®3£©”…DµзЉЂ…ѕ”–Їм…Ђќп÷ ќц≥цњ…÷™£ђЉ„≥Ўќ™»ЉЅѕµз≥Ў£ђЌ®»лґю—хїѓµ™µƒ“їЉЂќ™ЄЇЉЂ£їЉ”»лCu£®OH£©2 є»№“ЇЄі‘≠Ћµ√чµзљвєэ≥ћ÷–ѕ»µзљвЅтЋбЌ≠»№“Ї£ђЅтЋбЌ≠»№“ЇЌк»ЂµзљвЇуїєЉћ–шµзљвЅЋ≤њЈ÷ЋЃ£ї
£®4£©Ґўbµг ±£ђN2µƒћеїэЈ÷ э„оіу£ђ‘тЈі”¶ќпµƒќп÷ µƒЅњ÷Ѓ±»љ”љьµ»”Џїѓ—ІЉ∆Ѕњ э÷Ѓ±»£ї
ҐЏ‘ціуЈі”¶ќпCOµƒ≈®ґ»£ђ∆љЇвѕт’эЈі”¶Јљѕт“∆ґѓ£ђNOµƒ„™їѓ¬ ‘ціу£ђCOµƒ„™їѓ¬ Љх–°£ђ”…ЌЉњ…÷™£ђ![]() µƒ÷µ‘ціу£їЄ√Јі”¶ќ™Ј≈»»Јі”¶£ђ…эЄяќ¬ґ»£ђ∆љЇвѕтƒжЈі”¶Јљѕт“∆ґѓ£ђїѓ—І∆љЇв≥£ эЉх–°£ї
µƒ÷µ‘ціу£їЄ√Јі”¶ќ™Ј≈»»Јі”¶£ђ…эЄяќ¬ґ»£ђ∆љЇвѕтƒжЈі”¶Јљѕт“∆ґѓ£ђїѓ—І∆љЇв≥£ эЉх–°£ї
Ґџ”…ћв“вљ®ЅҐ»эґќ љ«уљвњ…µ√°£
£®1£©a£Ѓ‘ціуCO2µƒ≈®ґ»£ђЈі”¶ќп≈®ґ»‘ціу£ђ∆љЇвѕт’эЈі”¶Јљѕт“∆ґѓ£ђµЂCO2µƒ„™їѓ¬ Љх–°£ђє інќу£ї
b£ЃЄƒ±дєћћеµƒЅњ£ђ≤їƒ№Єƒ±дЈі”¶Ћў¬ £ђ≤їƒ№Єƒ±д∆љЇвµƒ“∆ґѓЈљѕт£ђ‘т»°„я“ї∞лC6H12O6£ђ∆љЇв≤ї“∆ґѓ£ђCO2µƒ„™їѓ¬ ≤ї±д£ђє інќу£ї
c£ЃіяїѓЉЅƒ№љµµЌЈі”¶µƒїоїѓƒ№£ђЉ”њмЈі”¶Ћў¬ £ђ≤їƒ№Єƒ±д∆љЇвµƒ“∆ґѓЈљѕт£ђ‘тЉ”»ліяїѓЉЅ£ђ∆љЇв≤ї“∆ґѓ£ђCO2µƒ„™їѓ¬ ≤ї±д£ђє інќу£ї
d£ЃЄ√Јі”¶ќ™ќь»»Јі”¶£ђ µ±…эЄяќ¬ґ»£ђ∆љЇвѕт’эЈі”¶Јљѕт“∆ґѓ£ђCO2µƒ„™їѓ¬ ‘ціу£ђє ’э»Ј£ї
d’э»Ј£ђє ір∞Єќ™£Їd£ї
£®2£©”…±нЄс эЊЁњ…÷™£ђ0°Ђ2minƒЏN2O5µƒ≈®ґ»±дїѓќ™£®1.00°™0.50£©mol/L=0.50mol/L£ђ‘тv(N2O5) £љ![]() =0.25 molL-1min-1£ђ”…їѓ—ІЈі”¶Ћў¬ ÷Ѓ±»µ»”Џїѓ—ІЉ∆Ѕњ э÷Ѓ±»њ…µ√v(NO2) £љ2v(N2O5) £љ
=0.25 molL-1min-1£ђ”…їѓ—ІЈі”¶Ћў¬ ÷Ѓ±»µ»”Џїѓ—ІЉ∆Ѕњ э÷Ѓ±»њ…µ√v(NO2) £љ2v(N2O5) £љ![]() °Ѕ2=0.5molL-1min-1£ђє ір∞Єќ™£Ї0.5£ї
°Ѕ2=0.5molL-1min-1£ђє ір∞Єќ™£Ї0.5£ї
£®3£©”…DµзЉЂ…ѕ”–Їм…Ђќп÷ ќц≥цњ…÷™£ђЉ„≥Ўќ™»ЉЅѕµз≥Ў£ђЌ®»лґю—хїѓµ™µƒ“їЉЂќ™ЄЇЉЂ£ђ‘тAЉЂЌ®»лґю—хїѓµ™£ђ‘ЏЋб–‘ћхЉюѕ¬£ђґю—хїѓµ™‘ЏЄЇЉЂ І»•µз„”ЈҐ…ъ—хїѓЈі”¶…ъ≥…ѕхЋб£ђµзЉЂЈі”¶ љќ™NO2£≠e-£ЂH2O=NO3-£Ђ2H£Ђ£їµзљвЅтЋбЌ≠»№“Їµƒїѓ—ІЈљ≥ћ љќ™2CuSO4+2H2O£ђ![]() 2Cu°э+O2°ь+2H2SO4£ђ”…Јљ≥ћ љњ…÷™Јі”¶Їу÷їќ –и“™Љ”»лCuOїтCuCO3ЊЌњ…“‘ є»№“ЇЄі‘≠£ђЉ”»лCu£®OH£©2 є»№“ЇЄі‘≠Ћµ√чµзљвєэ≥ћ÷–ѕ»µзљвЅтЋбЌ≠»№“Ї£ђЅтЋбЌ≠»№“ЇЌк»ЂµзљвЇуїєЉћ–шµзљвЅЋ≤њЈ÷ЋЃ£ђµзљв ±£ђ—фЉЂ Љ÷’ «OH£≠Ј≈µз£ђµзЉЂЈі”¶ љќ™4OH°™£≠4e°™=2H2O+O2°ь£ђ«в—хїѓЌ≠ «0.2mol£ђ‘тЄщЊЁ—х‘≠„” ЎЇгњ…÷™£ђЈі”¶÷–„™“∆µƒµз„” «0.2mol°Ѕ2°Ѕ2£љ0.8mol£ђє ір∞Єќ™£ЇNO2£їNO2£≠e-£ЂH2O=NO3-£Ђ2H£Ђ£ї0.8 mol£ї
2Cu°э+O2°ь+2H2SO4£ђ”…Јљ≥ћ љњ…÷™Јі”¶Їу÷їќ –и“™Љ”»лCuOїтCuCO3ЊЌњ…“‘ є»№“ЇЄі‘≠£ђЉ”»лCu£®OH£©2 є»№“ЇЄі‘≠Ћµ√чµзљвєэ≥ћ÷–ѕ»µзљвЅтЋбЌ≠»№“Ї£ђЅтЋбЌ≠»№“ЇЌк»ЂµзљвЇуїєЉћ–шµзљвЅЋ≤њЈ÷ЋЃ£ђµзљв ±£ђ—фЉЂ Љ÷’ «OH£≠Ј≈µз£ђµзЉЂЈі”¶ љќ™4OH°™£≠4e°™=2H2O+O2°ь£ђ«в—хїѓЌ≠ «0.2mol£ђ‘тЄщЊЁ—х‘≠„” ЎЇгњ…÷™£ђЈі”¶÷–„™“∆µƒµз„” «0.2mol°Ѕ2°Ѕ2£љ0.8mol£ђє ір∞Єќ™£ЇNO2£їNO2£≠e-£ЂH2O=NO3-£Ђ2H£Ђ£ї0.8 mol£ї
£®4£©Ґўbµг ±£ђN2µƒћеїэЈ÷ э„оіу£ђ‘тЈі”¶ќпµƒќп÷ µƒЅњ÷Ѓ±»љ”љьµ»”Џїѓ—ІЉ∆Ѕњ э÷Ѓ±»£ђ”…їѓ—ІЈљ≥ћ љњ…÷™£ђC°ҐN‘≠„”Єц э÷Ѓ±»љ”љь1:1£ђє ір∞Єќ™£Ї1:1£ї
ҐЏ‘ціуЈі”¶ќпCOµƒ≈®ґ»£ђ∆љЇвѕт’эЈі”¶Јљѕт“∆ґѓ£ђNOµƒ„™їѓ¬ ‘ціу£ђCOµƒ„™їѓ¬ Љх–°£ђ”…ЌЉњ…÷™£ђ![]() µƒ÷µ‘ціу£ђ a°Ґb°Ґc»эµгCOµƒ„™їѓ¬ ≥ Љх–°«ч ∆£ђ‘тa>b>c£їЄ√Јі”¶ќ™Ј≈»»Јі”¶£ђ…эЄяќ¬ґ»£ђ∆љЇвѕтƒжЈі”¶Јљѕт“∆ґѓ£ђїѓ—І∆љЇв≥£ эЉх–°£ђ”…ЌЉњ…÷™£ђN2µƒћеїэЈ÷ эT1>T2£ђ‘тЈі”¶ќ¬ґ»T2>T1£ђќ¬ґ»≤ї±д∆љЇв≥£ э≤ї±д£ђa°ҐcµƒЈі”¶ќ¬ґ»ѕаЌђ£ђ≤Ґ–°”Џd£ђ‘т∆љЇв≥£ эa£љc>d£ђє ір∞Єќ™£Їa>b>c£їa£љc>d£ї
µƒ÷µ‘ціу£ђ a°Ґb°Ґc»эµгCOµƒ„™їѓ¬ ≥ Љх–°«ч ∆£ђ‘тa>b>c£їЄ√Јі”¶ќ™Ј≈»»Јі”¶£ђ…эЄяќ¬ґ»£ђ∆љЇвѕтƒжЈі”¶Јљѕт“∆ґѓ£ђїѓ—І∆љЇв≥£ эЉх–°£ђ”…ЌЉњ…÷™£ђN2µƒћеїэЈ÷ эT1>T2£ђ‘тЈі”¶ќ¬ґ»T2>T1£ђќ¬ґ»≤ї±д∆љЇв≥£ э≤ї±д£ђa°ҐcµƒЈі”¶ќ¬ґ»ѕаЌђ£ђ≤Ґ–°”Џd£ђ‘т∆љЇв≥£ эa£љc>d£ђє ір∞Єќ™£Їa>b>c£їa£љc>d£ї
Ґџ»ф![]() £љ0.8£ђ…иCOµƒћеїэќ™0.8L£ђNOћеїэќ™1L£ђCOµƒ„™їѓ¬ ќ™a£ђ”…ћв“вљ®ЅҐ»зѕ¬»эґќ љ£Ї
£љ0.8£ђ…иCOµƒћеїэќ™0.8L£ђNOћеїэќ™1L£ђCOµƒ„™їѓ¬ ќ™a£ђ”…ћв“вљ®ЅҐ»зѕ¬»эґќ љ£Ї

”…N2µƒћеїэЈ÷ эќ™20%њ…µ√![]() =0.2£ђљвµ√a=0.75£ђ‘тCOµƒ„™їѓ¬ ќ™75%£ђє ір∞Єќ™£Ї75%°£
=0.2£ђљвµ√a=0.75£ђ‘тCOµƒ„™їѓ¬ ќ™75%£ђє ір∞Єќ™£Ї75%°£

 ‘ƒґЅњм≥µѕµЅ–ір∞Є
‘ƒґЅњм≥µѕµЅ–ір∞Є