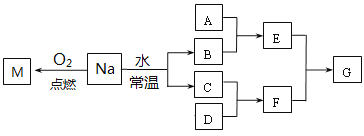
题目内容
【题目】二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向。CO2可转化成有机物实现碳循环。在 2 L 的恒温恒容密闭容器中,充入 2molCO2 和 6molH2,一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得 CO2 和 CH3OH(g)的浓度随时间变化如图:
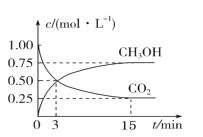
(1)从 3 min 到 15min,υ(H2)=____molL-1min-1;
(2)能说明上述反应达到平衡状态的是_____填编号)。
A. 反应中 CO2 与 CH3OH 的物质的量浓度之比为 1∶1(即图中交叉点)
B. 混合气体的压强不随时间的变化而变化
C. 单位时间内生成 1mol H2,同时生成 1mol CH3OH
D. 混合气体的平均密度不随时间的变化而变化
(3)平衡时 CO2 的转化率为 _____。
(4)平衡混合气体中 CO2(g)和 H2(g)的物质的量之比是 ______。
(5)第 3 分钟时υ正(CH3OH)______第 15 分钟时υ逆(CH3OH)(填“>”、“<” “=”)。
【答案】0.0625 B 75% 1:3 >
【解析】
(1)根据![]() 计算;
计算;
(2)反应达到平衡时任何物质的物质的量、浓度、含量等保持不变,据此判断;
(3)根据![]() 计算;
计算;
(4)根据加入的反应物的物质的量及物质反应转化关系判断平衡时两种气体的物质的量关系;
(5)根据平衡建立过程中正逆反应速率的变化判断。
(1)根据图示可知:从3 min到15 min,CO2的浓度从0.5 mol/L变为0.25 mol/L,c(CO2)=(0.50.25)mol/L=0.25mol/L,则c(H2)= 0.25mol/L×3=0.75 mol/L,故用H2浓度变化表示的反应速率![]() ;
;
(2)反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)在2 L的恒容密闭容器中进行,正反应是气体体积减小的反应,
CH3OH(g)+H2O(g)在2 L的恒容密闭容器中进行,正反应是气体体积减小的反应,
A. 反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点),由于CO2与CH3OH的浓度还在发生变化,说明反应未达到平衡,故A不符合题意;
B. 该反应在恒容密闭容器中进行,且该反应正反应是气体体积减小的反应,若混合气体的压强不随时间的变化而变化,说明气体的物质的量不变,反应达到平衡状态,故B符合题意;
C. 单位时间内生成1 mol H2,就会消耗![]() mol CH3OH,同时生成1 mol CH3OH,说明反应正向进行,未达到平衡状态,故C不符合题意;
mol CH3OH,同时生成1 mol CH3OH,说明反应正向进行,未达到平衡状态,故C不符合题意;
D. 该反应在恒容密闭容器中进行,且气体的总质量不变,则混合气体的平均密度始终不变,故混合气体的平均密度不随时间的变化而变化不能说明反应达到平衡状态,故D不符合题意;故答案为:B;
(3)根据图象可知:在反应开始时CO2浓度是1.00 mol/L,平衡时浓度为0.25 mol/L,所以CO2的平衡转化率=![]() ;
;
(4)反应开始时加入2 mol CO2和6 mol H2,根据方程式CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)可知:CO2和H2反应消耗的物质的量之比是1:3,因此平衡时CO2(g)和H2(g)的物质的量之比也是1:3;
CH3OH(g)+H2O(g)可知:CO2和H2反应消耗的物质的量之比是1:3,因此平衡时CO2(g)和H2(g)的物质的量之比也是1:3;
(5)该反应从正反应方向开始,随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大,当到第15 分钟时反应达到平衡,此时υ正(CH3OH)=υ逆(CH3OH),因此第3 分钟时υ正(CH3OH)>第15 分钟时υ逆(CH3OH)。

 阅读快车系列答案
阅读快车系列答案【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
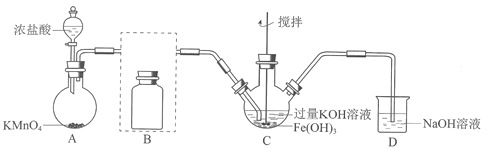
①A为氯气发生装置。A中反应方程式是________________(锰被还原为Mn2+)。
②将除杂装置B补充完整并标明所用试剂。_______
③C中得到紫色固体和溶液。C中Cl2发生的反应有
3Cl2+2Fe(OH)3+10KOH![]() 2K2FeO4+6KCl+8H2O,另外还有________________。
2K2FeO4+6KCl+8H2O,另外还有________________。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
i.由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________产生(用方程式表示)。
ii.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是________________。
②根据K2FeO4的制备实验得出:氧化性Cl2________![]() (填“>”或“<”),而方案Ⅱ实验表明,Cl2和
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和![]() 的氧化性强弱关系相反,原因是________________。
的氧化性强弱关系相反,原因是________________。
③资料表明,酸性溶液中的氧化性![]() >
>![]() ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性![]() >
>![]() 。若能,请说明理由;若不能,进一步设计实验方案。
。若能,请说明理由;若不能,进一步设计实验方案。
理由或方案:________________。
【题目】碳、氮是重要的非金属元素,在生产、生活中有广泛的应用。
(1)已知植物光合作用发生的反应如下:6CO2(g)+6H2O(l) ![]() C6H12O6(s)+6O2(g) △H=+669.62 kJmol-1该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是__________。
C6H12O6(s)+6O2(g) △H=+669.62 kJmol-1该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是__________。
a.增大CO2的浓度 b.取走一半C6H12O6
c.加入催化剂 d.适当升高温度
(2)N2O5的分解反应2N2O5(g)![]() 4NO2(g) + O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g) + O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
c(N2O5) /(molL﹣1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
计算在0~2min时段,化学反应速率v(NO2) =________molL-1min-1。
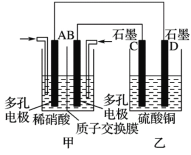
(3)若将NO2与O2通入甲中设计成如图所示装置,D电极上有红色物质析出,则A电极处通入的气体为_________(填化学式);A电极的电极反应式为_______________________,一段时间后,若乙中需加0.2 mol Cu(OH)2使溶液复原,则转移的电子的物质的量为 _____________。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如下图
N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如下图
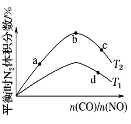
①b点时,平衡体系中C、N原子个数之比接近________________;
②a、b、c三点CO的转化率从大到小的顺序为____________;a、c、d三点的平衡常数从大到小的顺序为__________________。
③若![]() =0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为___________。
=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为___________。