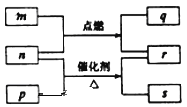
题目内容
【题目】下表是元素周期表的一部分。
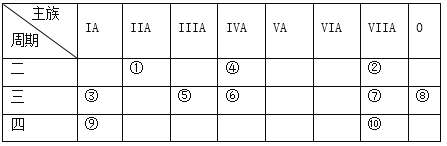
针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)在①~⑩元素中,金属性最强的元素是_______,最活泼的非金属元素是__________。
(2)化学性质最不活泼的元素是________,其原子的原子结构示意图为_________________。
(3)元素的最高价氧化物对应的水化物中酸性最强的是______________,碱性最强的是___________,呈两性的氢氧化物是____________。
(4)在②、③、⑤元素形成的简单离子中,离子半径最大的是________。
(5)在⑦与⑩的单质中,化学性质较活泼的是______,可用什么化学反应说明该事实(写出反应的化学方程式):___________________________。
(6)由③和⑦组成的化合物,溶于水制成饱和溶液,用石墨为电极电解该溶液,请写出阳极电极反应式_________________________ ,阴极产物(填化学式)是_____________ 。
【答案】 K F Ar 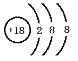 HClO4 KOH Al(OH)3 F- Cl2 Cl2+2NaBr=Br2+2NaCl 2Cl--2e- =Cl2↑ H2和NaOH
HClO4 KOH Al(OH)3 F- Cl2 Cl2+2NaBr=Br2+2NaCl 2Cl--2e- =Cl2↑ H2和NaOH
【解析】分析:由元素在周期表中的位置可以知道,(1)为Be,(2)为F,(3)为Na,(4)为C,(5)为Al,(6)为Si,(7)为Cl,(8)为Ar,(9)为K,(10)为Br。根据元素周期律进行解答。
(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中,金属性最强的元素是K,最活泼的非金属元素是F。因此,答案是:K;F。
(2)稀有气体Ar的化学性质最不活泼,其原子核外有18个电子,各层电子数为2、8、8,其原子结构示意图为: ,因此,答案是:Ar;
,因此,答案是:Ar; ;
;
(3)上述元素中除F(F没有正价)外Cl的非金属性最强,则最高价氧化物对应的水化物的酸性最强,该酸为HClO4,,K的金属性最强,则KOH的碱性最强,Al(OH)3为两性氢氧化物,因此,答案是: HClO4;KOH; Al(OH)3。
(4) ②为F、③为Na、⑤为Al,核外电子排布相同的粒子,核电荷数越大,粒子半径越小,所以F-离子半径最大;,因此,答案F-。
(5)同一主族从上到下非金属性减弱,单质的活泼性逐渐减弱,所以氯气的活泼性强于溴单质,可以通过水溶液中的置换反应来证明,反应方程式为: Cl2+2NaBr=Br2+2NaCl,因此答案是: Cl2; Cl2+2NaBr=Br2+2NaCl。
(6)由③为Na和⑦为Cl组成的化合物NaCl,溶于水制成饱和溶液,用石墨为电极电解该溶液,阳极电极反应式2Cl--2e- =Cl2↑,阴极电极反应式为:2H2O+4e-=H2↑+2OH-,所以阴极产物是H2和NaOH 。答案:2Cl--2e- =Cl2↑ H2和NaOH。

 阅读快车系列答案
阅读快车系列答案