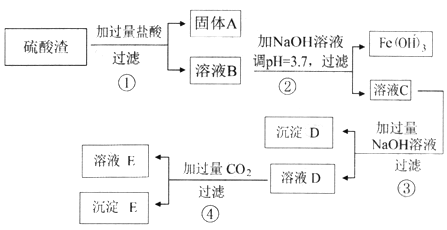
题目内容
【题目】氢氧燃料电池是一种新型的化学电源,其构造如图一所示:a、b两个电极均由多孔碳制成,通入的气体由孔隙中逸出,并在电极表面放电。
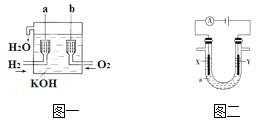
(1)a是________极,电极反应式是_______________________;b是________极.电极反应式是_______________________。
(2)该燃料电池生成了360 kg的水,则电路中通过了_____________mol的电子。
(3)用如图二所示电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是________,电极反应式是___________________。
②Y电极的材料是______________,电极反应式是_____________________。(说明:杂质发生的电极反应不必写出)
【答案】 负极 2H2 + 4OH-- 4e- = 4H2O 正极 O2 +2H2O+ 4e- = 4OH- 4×104 纯铜 Cu2++2e-===Cu 粗铜 Cu-2e-===Cu2+
【解析】(1)氢氧燃料电池中,通入氢气的一极为电源的负极,发生氧化反应,电极反应式为H2-2e+2OH-=2H2O,通入氧气的一极为原电池的正极,电极反应式为O2+4e-+2H2O=4OH-。(2)在2H2+O2=2H2O中,化合价升高值=化合价降低值=4,即当转移电子4mol时,会有2mol的水生成。
(1)氢氧燃料电池中,通入氢气的一极为电源的负极,通入氧气的一极为原电池的正极,因为电解质溶液呈碱性,则负极电极反应式为H2-2e+2OH-=2H2O ,正极电极反应式为O2+4e-+2H2O=4OH-,因此答案是: 负极 2H2+4OH--4e-=4H2O 正极 O2+2H2O+4e-=4OH-;
(2)氢氧燃料电池的总反应与氢气在氧气中燃烧的化学方程式相同,生成物为水,即H2-2e+2OH-=2H2O,在H2-2e+2OH-=2H2O中,化合价升高值=化合价降低值=4,即当转移电子4mol时,会有2mol即36g的水生成,当为飞行员提供了360 kg即2×104mol的水时,会转移电子4×104mol,因此,本题正确答案是: 4×104。
(2)①电解方法精炼粗铜,电解池的阴极X材料是纯铜,电极反应为:Cu2++2e-=Cu,因此,本题正确答案是:纯铜;Cu2++2e-=Cu。
②电解方法精炼粗铜,电解池的阳极材料是粗铜,电极反应为:Cu-2e-=Cu2+,因此,本题正确答案是:粗铜;Cu-2e-=Cu2+。

【题目】CO2是引起“温室效应”的主要物质,CO2的甲烷化可以实现其循环利用。
甲烷化过程中,可能发生如下反应:
I. CO2 (g)+4H2(g) ![]() CH4(g)+2H2O(g) △H1
CH4(g)+2H2O(g) △H1
II. CO2 (g)+4H2(g) ![]() CO(g)+2H2O(g) △H2
CO(g)+2H2O(g) △H2
已知反应II中相关的化学键键能数据如下:
化学键 | H—H | C=O | C | H—O |
E/(kJ·mol-1) | 436 | 750 | 1076 | 463 |
由此计算△H2=_________________。
(2)在常压、催化剂条件下,将CO2 和H2 (体积比为1:4,总物质的量为m mol)置于密闭容器中,发生反应I和II。测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)
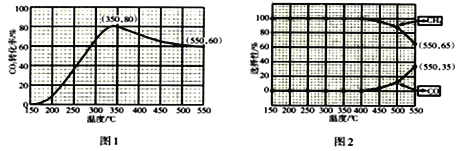
①由图1和图2可知,△H1___0(填“>”或“<”),____________可影响催化剂的选择性。
②由图1可知CO2的转化率呈现先升高后降低的变化趋势,其原因是________________________________。
③下列措施能提高CO2平衡转化率的是__________(填标号)
A.提高原料气中H2所占比例 B.适当增大压强 C.升高温度 D.增大催化剂的比表面积 E.前段加热,后段冷却
④350℃时,反应在t1时刻达到平衡,平衡时容器体积为VL,该温度下反应I的平衡常数为_____(用m、V表示)。
⑤550℃时,反应在t2时刻达到平衡,此时容器中H2O(g)的物质的量为__mol(用m表示)
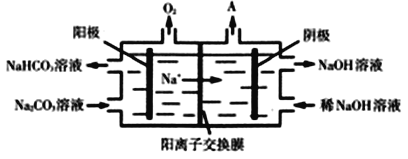
(3)CO2与NaOH溶液反应得到Na2CO3溶液。电解Na2CO3溶液的原理如图所示,阳极的电极反应式为______________________________________。
【题目】下列物质的分类正确的是
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | NaOH | H2SO4 | BaCO3 | SO2 | CO2 |
B | Ba(OH)2 | HCl | NaCl | Na2O | CO |
C | NaOH | CH3COOH | CaCl2 | CO | SO2 |
D | KOH | HClO | CaCO3 | CaO | SO3 |
A.AB.BC.CD.D