题目内容
【题目】10.8g某有机物A在纯氧中完全燃烧,仅生成二氧化碳30.8g,水7.2g,经过测定此有机物A相对分子质量为108.
(1)求此有机物A的分子式.
(2)若此有机物A跟FeCl3溶液作用显紫色,且有机物A与溴水反应,1mol 有机物A消耗3mol溴单质,写出此有机物A的结构简式以及A与溴水反应的化学方程式.
【答案】
(1)解:7.2gH2O中H原子的物质的量为: ![]() ×2=0.8mol,标况下30.8g CO2的物质的量为:
×2=0.8mol,标况下30.8g CO2的物质的量为: ![]() =0.7mol,则n(C)=0.7mol,
=0.7mol,则n(C)=0.7mol,
10.8g有机物中含有C、H元素的总质量为:m(C)+m(H)=0.7mol×12g/mol+0.8mol×1g/mol=9.2g,故10.8g有机物中m(O)=10.8g﹣9.2g=1.6gg,则n(O)= ![]() =0.1mol,
=0.1mol,
所以n(C):n(H):n(O)=0.7mol:0.8mol:0.1mol=7:8:1,该有机物的最简式为C7H8O,分子式为(C7H8O)n,又因相对分子质量为108,即108n=108,解得:n=1,所以该有机物的分子式为:C7H8O,
答:有机物A的分子式为C7H8O
(2)解:若此有机物A跟FeCl3溶液作用显紫色,则A分子中含有酚羟基,可能的结构简式有: ![]() 、
、 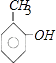 、
、 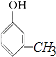 ,且有机物A与溴水反应,1mol 有机物A消耗3mol溴单质,则满足体积的只有
,且有机物A与溴水反应,1mol 有机物A消耗3mol溴单质,则满足体积的只有 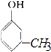 ,
,  与溴水反应的化学方程式为:
与溴水反应的化学方程式为: ![]() +3Br2→3HBr+
+3Br2→3HBr+ 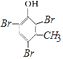 ,
,
答:有机物A的结构简式为 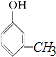 ,
,  与溴水反应的化学方程式为
与溴水反应的化学方程式为  +3Br2→3HBr+
+3Br2→3HBr+ 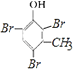
【解析】(1)根据n= ![]() 分别计算出二氧化碳30.8g,水7.2g的物质的量,然后根据C、H元素总质量确定O原子的存在情况,最后利用质量守恒定律确定A的分子式;(2)此有机物A跟FeCl3溶液作用显紫色,则A分子中含有酚羟基,再结合1mol 有机物A消耗3mol溴单质判断其结构简式,最后写出A与溴水反应的化学方程式.
分别计算出二氧化碳30.8g,水7.2g的物质的量,然后根据C、H元素总质量确定O原子的存在情况,最后利用质量守恒定律确定A的分子式;(2)此有机物A跟FeCl3溶液作用显紫色,则A分子中含有酚羟基,再结合1mol 有机物A消耗3mol溴单质判断其结构简式,最后写出A与溴水反应的化学方程式.