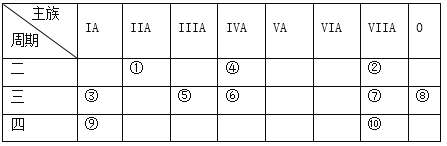
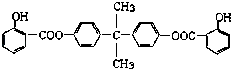
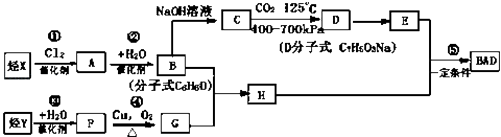
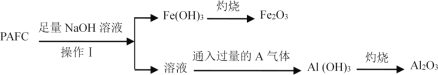��Ŀ����
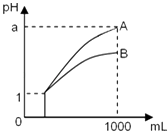
����Ŀ��ij�¶�ʱ����10mL.0.1mol/LCaCl2��Һ�еμ�0.1mol/L��Na2CO3��Һ���μӹ�������Һ��-1gc(Ca2+)��Na2CO3��Һ���(V)�Ĺ�ϵ��ͼ��ʾ�������й�˵����ȷ���ǣ� ��
(��֪1g5=0.7)

A. x��y����c(Ca2+)֮��Ϊ2000:3 B. Ksp(CaCO3)=5��10-9
C. w���Ӧ�ķ�ɢϵ���ȶ� D. x��y��z�����У�ˮ�ĵ���̶�����Ϊx��
���𰸡�A
��������A.x��ʱCa2+��![]() ǡ�÷�Ӧ����ʱ��-lgc(Ca2+)=4.3�����c(Ca2+)=c(
ǡ�÷�Ӧ����ʱ��-lgc(Ca2+)=4.3�����c(Ca2+)=c(![]() )=5��10-5mol��L-1��Ksp(CaCO3)= c(Ca2+)
)=5��10-5mol��L-1��Ksp(CaCO3)= c(Ca2+)![]() c(
c(![]() )=2.5��10-9��y����Һ��c(
)=2.5��10-9��y����Һ��c(![]() )=
)=![]() mol��L-1����c(Ca2+)=7.5��10-8mol��L-1��x��y����c(Ca2+)֮��Ϊ(5��10-5mol��L-1)��(7.5��10-8mol��L-1)=2 000��3��A��ȷ��B.x��ʱCa2+��
mol��L-1����c(Ca2+)=7.5��10-8mol��L-1��x��y����c(Ca2+)֮��Ϊ(5��10-5mol��L-1)��(7.5��10-8mol��L-1)=2 000��3��A��ȷ��B.x��ʱCa2+��![]() ǡ�÷�Ӧ����ʱ��-lgc(Ca2+)=4.3�����c(Ca2+)=c(
ǡ�÷�Ӧ����ʱ��-lgc(Ca2+)=4.3�����c(Ca2+)=c(![]() )=5��10-5mol��L-1��Ksp(CaCO3)= c(Ca2+)
)=5��10-5mol��L-1��Ksp(CaCO3)= c(Ca2+)![]() c(
c(![]() )=2.5��10-9 ��B����C.w��ʱQ(CaCO3)>Ksp(CaCO3)����ɢϵ���ڹ�����״̬�����ȶ���C����D. y��̼���ƹ�����̼࣬���ˮ��ٽ�ˮ�ĵ��룬���ˮ�ĵ���̶�����Ϊy�㣬D������ѡA.
)=2.5��10-9 ��B����C.w��ʱQ(CaCO3)>Ksp(CaCO3)����ɢϵ���ڹ�����״̬�����ȶ���C����D. y��̼���ƹ�����̼࣬���ˮ��ٽ�ˮ�ĵ��룬���ˮ�ĵ���̶�����Ϊy�㣬D������ѡA.

 �ƸԾ���Ȥζ����ϵ�д�
�ƸԾ���Ȥζ����ϵ�д� ����С����ҵ��ϵ�д�
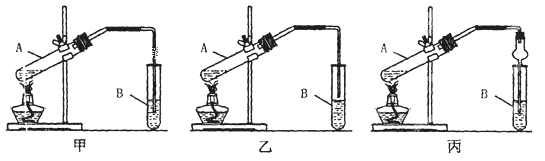
����С����ҵ��ϵ�д�����Ŀ��ʵ������������������Ҫװ����ͼA��ʾ����Ҫ�������a�Թ��а�2��3��2�����������Ũ���ᡢ�Ҵ�������Ļ����ڰ�Aͼ����װ�ã�ʹ����������������ͨ��b�Թ���ʢ�ı���̼������Һ(���뼸�η�̪��Һ)�У���С�����a�Թ��еĻ��Һ���ܵ�b�Թ����ռ���Լ2 mL����ʱֹͣ���ȡ�����b�Թܲ�������Ȼ���ô�����Һ��ֲ㣻�ݷ��������������������
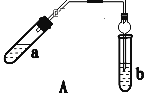
��ش��������⣺
(1) ������пɹ۲쵽b�Թ�����ϸС������ð����д���÷�Ӧ�����ӷ���ʽ��___��
(2) Aװ����ʹ�����ιܳ������������⣬��һ��Ҫ������___��������з���������������ʹ�õ�һ��������___��
(3) Ϊ֤��Ũ�����ڸ÷�Ӧ�����˴�������ˮ�������ã�ijͬѧ������ͼA��ʾװ�ý���������4��ʵ�顣ʵ�鿪ʼ���þƾ�����3min���ټ���ʹ֮����3min��ʵ�����������С�Թ�b�ٲ��л���ĺ�ȣ�ʵ���¼���£�
ʵ�� ��� | �Թ�a���Լ� | �Թ�b���Լ� | ����л���ĺ��/cm |
A | 3 mL�Ҵ���2 mL���ᡢ1mL 18mol��L-1Ũ���� | ����Na2CO3��Һ | 5.0 |
B | 3 mL�Ҵ���2 mL���� | 0.1 | |
C | 3 mL�Ҵ���2 mL���ᡢ6 mL 3mol��L-1H2SO4 | 1.2 | |
D | 3 mL�Ҵ���2 mL���ᡢ���� | 1.2 |
��ʵ��D��Ŀ������ʵ��C����գ�֤��H+��������Ӧ���д����á�ʵ��D��Ӧ��������������Ũ�ȷֱ���__mL��___mol��L-1��
�ڷ���ʵ��___(��ʵ����)�����ݣ������Ʋ��ŨH2SO4����ˮ����������������IJ��ʡ�Ũ�������ˮ���ܹ���������������ʵ�ԭ����___��
�ۼ���������������������IJ��ʣ���ʵ�鷢���¶ȹ������������IJ��ʷ������ͣ����ܵ�ԭ����___��
�ܷ�����������������ϴ�ӣ�Ϊ�˸�������������ѡ�õĸ����Ϊ__ (����ĸ)��
A.P2O5B.��ˮNa2SO4C.��ʯ��D.NaOH����