题目内容
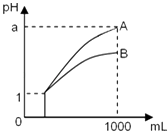
【题目】25℃时,0.1mol/L稀醋酸加水稀释,如图中的纵坐标y可以是( )
A.溶液的pH
B.醋酸的电离平衡常数
C.溶液中醋酸的物质的量浓度
D.醋酸的电离程度
【答案】C
【解析】A.醋酸是弱电解质,加水稀释促进醋酸电离,但酸的电离程度小于溶液体积增大程度,所以溶液中氢离子浓度逐渐减少,溶液的pH逐渐增大,但始终小于7,A不符合题意;
B.温度不变,醋酸的电离平衡常数不变,B不符合题意;
C.醋酸是弱电解质,加水稀释促进醋酸电离,但酸的电离程度小于溶液体积增大程度,所以溶液中氢离子、醋酸根离子浓度逐渐减少,醋酸溶液的物质的量浓度逐渐减小,C符合题意;
D.加水稀释促进醋酸电离,则醋酸的电离程度增大,D不符合题意;
所以答案是:C.
【考点精析】认真审题,首先需要了解弱电解质在水溶液中的电离平衡(当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理).

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
【题目】下列物质的分类正确的是
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | NaOH | H2SO4 | BaCO3 | SO2 | CO2 |
B | Ba(OH)2 | HCl | NaCl | Na2O | CO |
C | NaOH | CH3COOH | CaCl2 | CO | SO2 |
D | KOH | HClO | CaCO3 | CaO | SO3 |
A.AB.BC.CD.D
【题目】除去下列括号内的杂质,所加试剂和操作均正确的是( )
选项 | 需除杂的物质 | 试剂 | 操作 |
A | NaCl(Na2CO3) | 稀盐酸 | 蒸发结晶 |
B | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
C | Cl2(H2O) | 碱石灰 | 洗气 |
D | CO2(CO) | ﹣﹣ | 点燃 |
A.A
B.B
C.C
D.D