题目内容
A、B、C、D、E、F、G、H是元素周期表中八种原子序数依次增大的短周期元素.
①A元素的原子半径在周期表中最小
②B元素的原子最外层电子数是次外层电子数的两倍
③C元素的最高价氧化物的水化物和氢化物反应生成盐
④D元素和E元素可以形成E2D、E2D2两种离子化合物
⑤G与D两种元素同主族,F、G、H三种元素同周期
⑥F元素是同周元素中离子半径最小的元素,H元素是同周期元素中原子半径最小的元素
(1)写出A、D、E三种元素形成的化合物的电子式 ;
(2)用惰性电极电解由E与H两元素形成的化合物的水溶液,其化学方程式为 ;
(3)八种元素中任意三种组成的易溶于水的酸性物质,能促进水电离的是 ,能抑制水电离的是 (各写一种化学式);
(4)某科研单位依据电化学原理用GD2来制备一种强酸R,装置如图,电极为含有某种催化剂的多孔材料,能吸附气体,同时也能使气体与电解质溶液充分接触.通入GD2的电极为 极,其电极反应式为 ;

(5)甲、乙、丙分别是B、F、G三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应产物不同.回答问题:
①向甲溶液中缓慢滴加过量的丙溶液,可观察到的实验现象是 ;
②向乙溶液中缓慢滴加过量的丙溶液发生反应的离子方程式为 、 .
①A元素的原子半径在周期表中最小
②B元素的原子最外层电子数是次外层电子数的两倍
③C元素的最高价氧化物的水化物和氢化物反应生成盐
④D元素和E元素可以形成E2D、E2D2两种离子化合物
⑤G与D两种元素同主族,F、G、H三种元素同周期
⑥F元素是同周元素中离子半径最小的元素,H元素是同周期元素中原子半径最小的元素
(1)写出A、D、E三种元素形成的化合物的电子式
(2)用惰性电极电解由E与H两元素形成的化合物的水溶液,其化学方程式为
(3)八种元素中任意三种组成的易溶于水的酸性物质,能促进水电离的是
(4)某科研单位依据电化学原理用GD2来制备一种强酸R,装置如图,电极为含有某种催化剂的多孔材料,能吸附气体,同时也能使气体与电解质溶液充分接触.通入GD2的电极为

(5)甲、乙、丙分别是B、F、G三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应产物不同.回答问题:
①向甲溶液中缓慢滴加过量的丙溶液,可观察到的实验现象是
②向乙溶液中缓慢滴加过量的丙溶液发生反应的离子方程式为
分析:A、B、C、D、E、F、G、H是元素周期表中八种原子序数依次增大的短周期元素,
①A元素的原子半径在周期表中最小,A为H元素;
②B元素的原子最外层电子数是次外层电子数的两倍,有2个电子层,最外层电子数为4,B为C元素;
③C元素的最高价氧化物的水化物和氢化物反应生成盐,C为N元素;
④D元素和E元素可以形成E2D、E2D2两种离子化合物,E为Na元素,D为O元素;
⑤G与D两种元素同主族,故G为S元素,F、G、H三种元素同周期,处于第三周期;
⑥F元素是同周元素中离子半径最小的元素,H元素是同周期元素中原子半径最小的元素,F为Al元素,H为Cl元素;
(1)A、D、E三种元素形成的化合物是NaOH,属于离子化合物,由钠离子与氢氧根离子构成;
(2)E与H两元素形成的化合物为NaCl,电解NaCl溶液生成氢气、氯气、氢氧化钠;
(3)易溶于水的酸性物质,能促进水电离的是强酸弱碱盐,能抑制水电离是酸;
(4)用SO2来制备一种强酸为H2SO4,反应中SO2发生氧化反应,应在负极通入,SO2在负极放电,有水参加,反应生成氢离子与硫酸根离子;
(5)甲、乙、丙分别是B、F、G三种元素最高价含氧酸的钠盐,乙为NaAlO2,甲、乙都能与丙发生反应,且丙用量不同,反应产物不同,故甲为Na2CO3、丙为NaHSO4,
①向Na2CO3溶液中缓慢滴加过量的NaHSO4溶液,先生成碳酸氢钠,碳酸钠完全转化为碳酸氢钠后,碳酸氢根离子与氢离子反应生成二氧化碳;
②向NaAlO2溶液中缓慢滴加过量的NaHSO4溶液,开始偏铝酸根与氢离子反应生成氢氧化铝沉淀,偏铝酸根反应完毕,氢氧化铝与氢离子反应生成铝离子与水.
①A元素的原子半径在周期表中最小,A为H元素;
②B元素的原子最外层电子数是次外层电子数的两倍,有2个电子层,最外层电子数为4,B为C元素;
③C元素的最高价氧化物的水化物和氢化物反应生成盐,C为N元素;
④D元素和E元素可以形成E2D、E2D2两种离子化合物,E为Na元素,D为O元素;
⑤G与D两种元素同主族,故G为S元素,F、G、H三种元素同周期,处于第三周期;
⑥F元素是同周元素中离子半径最小的元素,H元素是同周期元素中原子半径最小的元素,F为Al元素,H为Cl元素;
(1)A、D、E三种元素形成的化合物是NaOH,属于离子化合物,由钠离子与氢氧根离子构成;
(2)E与H两元素形成的化合物为NaCl,电解NaCl溶液生成氢气、氯气、氢氧化钠;
(3)易溶于水的酸性物质,能促进水电离的是强酸弱碱盐,能抑制水电离是酸;
(4)用SO2来制备一种强酸为H2SO4,反应中SO2发生氧化反应,应在负极通入,SO2在负极放电,有水参加,反应生成氢离子与硫酸根离子;
(5)甲、乙、丙分别是B、F、G三种元素最高价含氧酸的钠盐,乙为NaAlO2,甲、乙都能与丙发生反应,且丙用量不同,反应产物不同,故甲为Na2CO3、丙为NaHSO4,
①向Na2CO3溶液中缓慢滴加过量的NaHSO4溶液,先生成碳酸氢钠,碳酸钠完全转化为碳酸氢钠后,碳酸氢根离子与氢离子反应生成二氧化碳;
②向NaAlO2溶液中缓慢滴加过量的NaHSO4溶液,开始偏铝酸根与氢离子反应生成氢氧化铝沉淀,偏铝酸根反应完毕,氢氧化铝与氢离子反应生成铝离子与水.
解答:解:A、B、C、D、E、F、G、H是元素周期表中八种原子序数依次增大的短周期元素,
①A元素的原子半径在周期表中最小,A为H元素;
②B元素的原子最外层电子数是次外层电子数的两倍,有2个电子层,最外层电子数为4,B为C元素;
③C元素的最高价氧化物的水化物和氢化物反应生成盐,C为N元素;
④D元素和E元素可以形成E2D、E2D2两种离子化合物,E为Na元素,D为O元素;
⑤G与D两种元素同主族,故G为S元素,F、G、H三种元素同周期,处于第三周期;
⑥F元素是同周元素中离子半径最小的元素,H元素是同周期元素中原子半径最小的元素,F为Al元素,H为Cl元素;
(1)A、D、E三种元素形成的化合物是NaOH,属于离子化合物,由钠离子与氢氧根离子构成,电子式为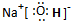 ,故答案为:
,故答案为: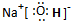 ;
;
(2)E与H两元素形成的化合物为NaCl,电解NaCl溶液生成氢气、氯气、氢氧化钠,反应方程式为:
2NaCl+2H2O
H2↑+Cl2↑+2NaOH,故答案为:2NaCl+2H2O
H2↑+Cl2↑+2NaOH;
(3)八种元素中任意三种组成的易溶于水的酸性物质,能促进水电离的是为强酸弱碱盐,如Al2(SO4)3,能抑制水电离,为酸,如HNO3,故答案为:Al2(SO4)3;HNO3;
(4)用SO2来制备一种强酸为H2SO4,反应中SO2发生氧化反应,应在负极通入,SO2在负极放电,有水参加,反应生成氢离子与硫酸根离子,电解反应式为:SO2+2H2O-2e-=4H++SO42-,故答案为:负,SO2+2H2O-2e-=4H++SO42-;
(5)甲、乙、丙分别是B、F、G三种元素最高价含氧酸的钠盐,乙为NaAlO2,甲、乙都能与丙发生反应,且丙用量不同,反应产物不同,故甲为Na2CO3、丙为NaHSO4,
①向Na2CO3溶液中缓慢滴加过量的NaHSO4溶液,先生成碳酸氢钠,碳酸钠完全转化为碳酸氢钠后,碳酸氢根离子与氢离子反应生成二氧化碳,故可观察到的实验现象是:开始无明显现象,后来有大量气体生成,
故答案为:开始无明显现象,后来有大量气体生成;
②向NaAlO2溶液中缓慢滴加过量的NaHSO4溶液,开始偏铝酸根与氢离子反应生成氢氧化铝沉淀,偏铝酸根反应完毕,氢氧化铝与氢离子反应生成铝离子与水,反应离子方程式为:AlO2-+H++H2O=Al(OH)3↓,Al(OH)3+3H+=Al3++3H2O,
故答案为:AlO2-+H++H2O=Al(OH)3↓;Al(OH)3+3H+=Al3++3H2O.
①A元素的原子半径在周期表中最小,A为H元素;
②B元素的原子最外层电子数是次外层电子数的两倍,有2个电子层,最外层电子数为4,B为C元素;
③C元素的最高价氧化物的水化物和氢化物反应生成盐,C为N元素;
④D元素和E元素可以形成E2D、E2D2两种离子化合物,E为Na元素,D为O元素;
⑤G与D两种元素同主族,故G为S元素,F、G、H三种元素同周期,处于第三周期;
⑥F元素是同周元素中离子半径最小的元素,H元素是同周期元素中原子半径最小的元素,F为Al元素,H为Cl元素;
(1)A、D、E三种元素形成的化合物是NaOH,属于离子化合物,由钠离子与氢氧根离子构成,电子式为
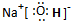 ,故答案为:
,故答案为: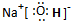 ;
;(2)E与H两元素形成的化合物为NaCl,电解NaCl溶液生成氢气、氯气、氢氧化钠,反应方程式为:
2NaCl+2H2O
| ||
| ||
(3)八种元素中任意三种组成的易溶于水的酸性物质,能促进水电离的是为强酸弱碱盐,如Al2(SO4)3,能抑制水电离,为酸,如HNO3,故答案为:Al2(SO4)3;HNO3;
(4)用SO2来制备一种强酸为H2SO4,反应中SO2发生氧化反应,应在负极通入,SO2在负极放电,有水参加,反应生成氢离子与硫酸根离子,电解反应式为:SO2+2H2O-2e-=4H++SO42-,故答案为:负,SO2+2H2O-2e-=4H++SO42-;
(5)甲、乙、丙分别是B、F、G三种元素最高价含氧酸的钠盐,乙为NaAlO2,甲、乙都能与丙发生反应,且丙用量不同,反应产物不同,故甲为Na2CO3、丙为NaHSO4,
①向Na2CO3溶液中缓慢滴加过量的NaHSO4溶液,先生成碳酸氢钠,碳酸钠完全转化为碳酸氢钠后,碳酸氢根离子与氢离子反应生成二氧化碳,故可观察到的实验现象是:开始无明显现象,后来有大量气体生成,
故答案为:开始无明显现象,后来有大量气体生成;
②向NaAlO2溶液中缓慢滴加过量的NaHSO4溶液,开始偏铝酸根与氢离子反应生成氢氧化铝沉淀,偏铝酸根反应完毕,氢氧化铝与氢离子反应生成铝离子与水,反应离子方程式为:AlO2-+H++H2O=Al(OH)3↓,Al(OH)3+3H+=Al3++3H2O,
故答案为:AlO2-+H++H2O=Al(OH)3↓;Al(OH)3+3H+=Al3++3H2O.
点评:本题以元素推断为载体,考查常用化学用语书写、电解原理、原电池、盐类水解、元素化合物的性质等,题目综合性较大,注意(4)中本质为二氧化硫在水中与氧气反应生成硫酸,电极反应式书写为难点、易错点.

练习册系列答案
相关题目
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.