题目内容
下列物质的应用不涉及氧化还原反应的是
| A.用稀硝酸洗去附在试管内壁的银镜 |
| B.用热的纯碱溶液清洗油污 |
| C.用新制的氢氧化铜悬浊液与病人的尿液混和加热,来检验病人是否患糖尿病 |
| D.在铁质镀件上镀铜 |
B
解析试题分析:稀硝酸具有氢氧化性,能氧化或腐蚀氢后不活泼金属,即3Ag+4HNO3=3AgNO3+NO↑+2H2O,因此可用稀硝酸洗涤银镜,涉及氧化还原反应,故A选项错误;纯碱为碳酸钠,Na2CO3属于强碱弱酸盐,能水解,其溶液呈碱性,且其水解反应是吸热反应,热的纯碱溶液碱性增强,能促进油脂水解且使反应速率加快,但上述变化不涉及氧化还原反应,故B选项正确;虽然新制氢氧化铜悬浊液是弱氧化剂,但能氧化葡萄糖,二者混合加热时生成砖红色沉淀,涉及氧化还原反应,故C选项错误;电镀铜时,纯铜作阳极,发生氧化反应,铁质镀件作阴极,铜盐溶液为电镀液,铜离子移向阴极并在阴极上得到电子,发生还原反应,析出铜覆盖在铁质镀件上,因此涉及氧化还原反应,故D选项错误。
考点:考查考生对氧化还原反应概念及其本质、特征的理解;考查考生对常见氧化还原反应的熟悉程度及其在工业生产中的应用;考查考生对常见元素的单质和重要化合物的主要性质的掌握;考生考生对盐类水解规律的了解;考查考生对油脂、葡萄糖的特征反应的了解程度。

 名校课堂系列答案
名校课堂系列答案钛被誉为“21世纪金属”。工业冶炼钛的第一步反应为:
TiO2+2C+2Cl2 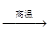 TiCl4+2CO。下列关于该反应的说法正确的是
TiCl4+2CO。下列关于该反应的说法正确的是
| A.TiO2是氧化剂 |
| B.氧化剂与还原剂的物质的量之比为1:1 |
| C.Cl2发生氧化反应 |
| D.当2 mol C参加反应时,转移的电子数目为2 mol |
下列物质的工业生产过程中,其主要反应不涉及氧化还原反应的是
| A.纯碱 | B.烧碱 | C.硫酸 | D.硝酸 |
铋(Bi)位于元素周期表中VA族,其价态为+3时较稳定,铋酸钠(NaBiO3)可氧化硫酸锰(MnSO4),反应的离子方程式为5NaBiO3+2Mn2++14H+=2MnO- 4+5Bi3++Na++7H2O,下列说法错误的是
| A.若有0.1mol氧化产物生成,则转移0.5mol电子 |
| B.铋酸钠难溶于水 |
| C.该反应可以用于鉴定Mn2+离子 |
| D.该反应可以用浓盐酸酸化 |
在碘酸钠(NaIO3)的碱性溶液中通入Cl2,可以得到高碘酸钠(Na2H3IO6)。下列有关该反应的说法正确的是
| A.该反应中Cl2作还原剂 |
| B.碱性条件下,NaIO3的氧化性强于Na2H3IO6 |
| C.反应中每生成1 mol Na2H3IO6,转移2 mol电子 |
| D.反应中氧化产物与还原产物的物质的量之比为2 : 1 |
在熔融KOH中大气中的氧可将铬铁矿FeCr2O4中Fe和Cr的化合价都转化为+6价,氧化 1 mol FeCr2O4在理论上需要多少摩尔氧气
| A.2mol | B.2.5mol | C.3mol | D.4mol |
已知5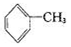 +6KMnO4+9H2SO4=3K2SO4+6MnSO4+14H2O+_______。
+6KMnO4+9H2SO4=3K2SO4+6MnSO4+14H2O+_______。
下列说法不正确的是
A.氧化产物为 | B. 作氧化剂 作氧化剂 |
| C.每1mol KMnO4转移5mol e- | D.H2SO4起酸的作用 |
已知Br2+ 2Fe2+ = 2Fe3++ 2 Br-,当向含1 molFeBr2溶液中逐渐通入Cl2,溶液中有一半的Br-氧化时,下列判断不正确的是
| A.反应前后溶液的颜色发生了改变 |
| B.反应后溶液中c(Cl-)= C(Br-) |
| C.参加反应的Cl2为1 mol |
| D.反应的离子方程式为:2Fe2++ 2Br- + 2Cl2= 2Fe3++ Br2 + 4Cl- |