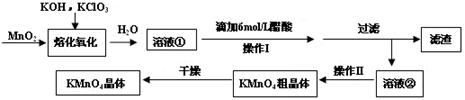
题目内容
已知Br2+ 2Fe2+ = 2Fe3++ 2 Br-,当向含1 molFeBr2溶液中逐渐通入Cl2,溶液中有一半的Br-氧化时,下列判断不正确的是
| A.反应前后溶液的颜色发生了改变 |
| B.反应后溶液中c(Cl-)= C(Br-) |
| C.参加反应的Cl2为1 mol |
| D.反应的离子方程式为:2Fe2++ 2Br- + 2Cl2= 2Fe3++ Br2 + 4Cl- |
B
解析试题分析:有一半的Br-被氧化时,Fe2+已被全被氧化为Fe3+,溶液颜色由浅绿色变为棕黄色,A正确;溶液中发生的反应为2Fe2++Cl2=2Fe3++2Cl-,2Br-+Cl2=2Cl-+Br2,反应后溶液中Cl-的物质的量为1.5mol,Br-的物质的量为1mol,溶液体积相同,故c(Cl-)≠c(Br-),B错;根据反应及参加反应的各离子的物质的量,可计算出参加反应的Cl2为1mol,C正确;反应总的离子方程式为2Fe2++ 2Br- + 2Cl2= 2Fe3++ Br2 + 4Cl-,D正确。
考点:考查氧化还原反应及相关计算。

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
下列叙述正确的是
| A.浓硫酸可干燥H2、SO2、NH3等气体 |
| B.久置于空气中的氢氧化钠溶液,加足量盐酸时有气体产生 |
| C.因海水中含有镁元素,故不需经过化学变化就可以得到镁单质 |
| D.足量的硫单质与64g铜反应,有2mol电子发生转移 |
下列物质的应用不涉及氧化还原反应的是
| A.用稀硝酸洗去附在试管内壁的银镜 |
| B.用热的纯碱溶液清洗油污 |
| C.用新制的氢氧化铜悬浊液与病人的尿液混和加热,来检验病人是否患糖尿病 |
| D.在铁质镀件上镀铜 |
现有含Fe(NO3)3、Cu(NO3)2、HNO3的某稀溶液,若向其中逐步加入铁粉,溶液中Fe2+浓度与加入铁粉的物质的量之间的关系如图所示,则该溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为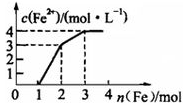
| A.1∶1∶3 | B.1∶2∶4 | C.1∶1∶4 | D.1∶3∶1 |
氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的是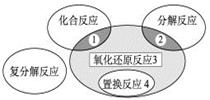
A.2H2+O2 2H2O 2H2O |
B.2NaHCO3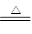 Na2CO3+H2O +CO2↑ Na2CO3+H2O +CO2↑ |
| C.Zn +H2SO4= ZnSO4 + H2↑ |
D.CuO+CO  Cu + CO2 Cu + CO2 |
判断下列有关化学基本概念的依据正确的是
| A.胶体:组成物质的直径是否在1nm~100nm之间 |
| B.氧化还原反应:反应前后元素的化合价是否发生了变化 |
| C.共价化合物:组成化合物的元素是否全部都是非金属元素 |
| D.化学变化:是否有热效应、颜色变化、气体或沉淀生成等四种实验现象 |