题目内容
在碘酸钠(NaIO3)的碱性溶液中通入Cl2,可以得到高碘酸钠(Na2H3IO6)。下列有关该反应的说法正确的是
| A.该反应中Cl2作还原剂 |
| B.碱性条件下,NaIO3的氧化性强于Na2H3IO6 |
| C.反应中每生成1 mol Na2H3IO6,转移2 mol电子 |
| D.反应中氧化产物与还原产物的物质的量之比为2 : 1 |
C
解析试题分析:高碘酸钠(Na2H3IO6)中碘的化合价为+7价,故碘酸钠(NaIO3)中碘的化合价升高,做还原剂;Cl2化合价降低,做氧化剂。A、错误;B、碱性条件下,NaIO3的还原性强于Na2H3IO6,错误;C、碘元素由+5价变为+7,化合价增大2,故反应中每生成1 mol Na2H3IO6,转移2 mol电子,正确;D、根据电子守恒,NaIO3与Cl2按1:1反应,分别生成氧化产物与还原产物的物质的量之比为1 : 2,错误。
考点:考查氧化还原反应有关基本概念的判断、电子转移等有关问题。

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
将0.15mol Fe3O4完全溶解在足量稀硫酸中,然后加入K2Cr2O7溶液250mL,恰好使溶液中Fe2+全部氧化成Fe3+,Cr2O72-全部转化成Cr3+,则K2Cr2O7溶液的物质的量浓度是
| A.0.05mol/L | B.0.1mol/L | C.0.2mol/L | D.0.3mol/L |
下列过程不涉及氧化还原反应的是
| A.燃放鞭炮 | B.氯化铵和熟石灰混合加热制氨气 |
| C.金属冶炼 | D.浓盐酸和二氧化锰混合加热制氯气 |
由反应:①Tl3++2Ag→Tl++2Ag+;②Fe+Cu2+→Fe2++Cu;③2Ag++Cu→Cu2++2Ag 得出的结论正确的是
| A.氧化性:Ag+>Tl3+>Cu2+>Fe2+ | B.还原性: Fe>Cu>Ag>Tl |
| C.氧化性:Tl 3+>Ag+>Cu 2+>Fe 2+ | D.还原性: Tl +>Ag>Cu>Fe |
不涉及氧化还原反应的是
| A.海水提镁 | B.明矶净水 | C.工业固氮 | D.电池充电 |
下列物质的应用不涉及氧化还原反应的是
| A.用稀硝酸洗去附在试管内壁的银镜 |
| B.用热的纯碱溶液清洗油污 |
| C.用新制的氢氧化铜悬浊液与病人的尿液混和加热,来检验病人是否患糖尿病 |
| D.在铁质镀件上镀铜 |
氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的是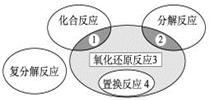
A.2H2+O2 2H2O 2H2O |
B.2NaHCO3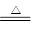 Na2CO3+H2O +CO2↑ Na2CO3+H2O +CO2↑ |
| C.Zn +H2SO4= ZnSO4 + H2↑ |
D.CuO+CO 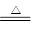 Cu + CO2 Cu + CO2 |
 Cl2↑+H2↑+2NaOH。
Cl2↑+H2↑+2NaOH。 Cl2↑+ Cu d.3Cl2 + 2Fe
Cl2↑+ Cu d.3Cl2 + 2Fe 2FeCl3
2FeCl3