题目内容
9.下列叙述正确的是( )| A. | 向溴水中滴入植物油,振荡后油层仍显无色,因此溴不溶于油脂 | |
| B. | FeCl3溶液可以腐蚀线路板上的Cu,因此Fe的金属活动性大于Cu | |
| C. | 常温下,2NO(g)+O2(g)=2NO2(g),因此该反应△H<0 | |
| D. | 相同浓度的Na2CO3溶液的碱性强于C6H5ONa,因此C6H5OH的酸性强于H2CO3 |
分析 A、植物油是由不饱和的高级脂肪酸和甘油形成的酯,含有不饱和键;
B、金属铜可以和氯化铁发生反应生成氯化亚铁和氯化铜,金属的置换反应可以证明金属的活泼性;
C、2NO(g)+O2(g)=2NO2(g),该反应为熵减的反应,常温下能自发进行说明此反应为放热反应;
D、Na2CO3溶液的碱性强于C6H5ONa,说明酸性C6H5OH的酸性强于HCO3-.
解答 解:A、植物油中含有不饱和键与溴发生加成反应使溴水褪色,故A错误;
B、金属铁可以将金属铜从盐中置换出来,可以证明Fe的金属活动性大于Cu,但是金属铜可以和氯化铁发生反应生成氯化亚铁和氯化铜,不是置换反应,故B错误;
C、2NO(g)+O2(g)=2NO2(g),该反应为熵减的反应,常温下能自发进行说明此反应为放热反应,即△H<0,故C正确;
D、Na2CO3溶液的碱性强于C6H5ONa,说明酸性C6H5OH的酸性强于HCO3-,故D错误,
故选C.
点评 本题主要考查的是双键的性质、金属活动性顺序应用、化学反应能否进行的判据、酸性强弱比较等,综合性较强,有一定难度.

练习册系列答案
相关题目
13.下列分离提纯的方法正确的是( )
| A. | 用酒精提取碘水中的碘 | |
| B. | 重结晶法除去硝酸钾中的氯化钠 | |
| C. | 蒸馏法分离乙醇和苯酚 | |
| D. | 除去乙烷中少量的乙烯,方法是在光照条件下通氯气 |
14.已知自然界氧的同位素有16O、17O、18O,氢的同位素有H、D、T,从水分子的组成来看,自然界的水一共有( )
| A. | 3种 | B. | 6种 | C. | 9种 | D. | 18种 |
14.下列说法正确的是( )
| A. | 原子最外层电子数为2的元素一定处于周期表IIA族 | |
| B. | 主族元素X、Y能形成XY2型化合物,则X与Y 的原子序数之差可能为2或5 | |
| C. | 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 | |
| D. | 同主族元素形成的氧化物的晶体类型均相同 |
1.下列实验事实与对应的方程式使用正确的是( )
| A. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3+CO32- | |
| B. | 硫酸酸化的淀粉KI溶液在空气中变成蓝色:4I++O2+2H2O═2I2+4OH- | |
| C. | 钢铁发生吸氧腐蚀时,正极的电极反应式:O2+4e-+2H2O═4OH- | |
| D. | 氨气催化氧化生产硝酸的主要反应:4NH3+7O2催化剂_高温4NO2+6H2O |
18.下列说法正确的是( )
| A. | 100℃时,KW=10-12,此温度下pH=6的溶液一定显酸性 | |
| B. | 25℃时,0.1mol/L的NaHSO3溶液pH=4,说明该溶液中c(HSO3-)>c(SO32-) | |
| C. | NH4Cl、CH3COONa、NaHCO3、NaHSO4溶于水,对水的电离都有促进作用 | |
| D. | 25℃时,10mL0.1mol/L CH3COOH溶液与5mL 0.1mol/LNaOH溶液混合,所得溶液中有2c(Na+)═c(CH3COO-)+c(CH3COOH) |
 .
.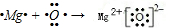 .
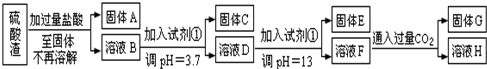
.
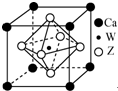 原子序数小于36的X、Y、Z、W四种元素,X基态原子的最外层电子数是其内层电子数的2倍,Y基态原子的2p原子轨道上有3个未成对电子,Z是地壳中含量最多的元素,W的原子序数为22.
原子序数小于36的X、Y、Z、W四种元素,X基态原子的最外层电子数是其内层电子数的2倍,Y基态原子的2p原子轨道上有3个未成对电子,Z是地壳中含量最多的元素,W的原子序数为22.