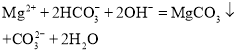题目内容
【题目】下列离子方程式书写及评价合理的是( )
选项 | 离子方程式 | 评价 |
A |
| 正确, |
B |
| 正确, |
C | 将少量的 | 正确, |
D | 将 | 错误, |
A.AB.BC.CD.D
【答案】B
【解析】
A.Mg(HCO3)2溶液中加入足量NaOH溶液,反应生成碳酸钠、氢氧化镁沉淀和水,正确的离子方程式为:Mg2++2HCO3+4OH═Mg(OH)2↓+2CO32+2H2O,故A错误;
B.1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积互相均匀混合,设溶液体积为1L,偏铝酸钠和HCl的物质的量分别为1mol、2.5mol,1mol偏铝酸钠消耗1molHCl生成1mol氢氧化铝,剩余的1.5molHCl能够溶解0.5mol氢氧化铝,反应的离子方程式为:2AlO2+5H+═Al3++Al(OH)3↓+H2O,故B正确;
C.Fe3O4与过量的稀HNO3反应,生成的亚铁离子被稀硝酸氧化成了铁离子,正确的离子方程式为:3Fe3O4+NO3+28H+═9Fe3++14H2O+NO↑,故C错误;
D.NaClO溶液与FeCl2溶液混合,二者发生氧化还原反应,正确的离子反应为:2Fe2++5ClO+5H2O═2Fe(OH)3↓+Cl+4HClO,故D错误;
答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】三氯乙醛(CCl3CHO)是生产农药、医药的重要中间体,实验室制备三氯乙醛的反应装置示意图(加热装置未画出)和有关数据如下:
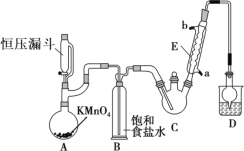
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
②相关物质的相对分子质量及部分物理性质:
相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
C2H5OH | 46 | -114.1 | 78.3 | 与水互溶 |
CCl3CHO | 147.5 | -57.5 | 97.8 | 可溶于水、乙醇 |
CCl3COOH | 163.5 | 58 | 198 | 可溶于水、乙醇、三氯乙醛 |
C2H5Cl | 64.5 | -138.7 | 12.3 | 微溶于水,可溶于乙醇 |
(1)恒压漏斗中盛放的试剂的名称是_____,盛放KMnO4仪器的名称是_____。
(2)反应过程中C2H5OH和HCl可能会生成副产物C2H5Cl,同时CCl3CHO(三氯乙醛)也能被次氯酸继续氧化生成CCl3COOH(三氯乙酸),写出三氯乙醛被次氯酸氧化生成三氯乙酸的化学方程式:_____。
(3)该设计流程中存在一处缺陷是_____,导致引起的后果是_____,装置B的作用是______。
(4)反应结束后,有人提出先将C中的混合物冷却到室温,再用分液的方法分离出三氯乙酸。你认为此方案是否可行_____(填是或否),原因是_____。
(5)测定产品纯度:称取产品0.36g配成待测溶液,加入0.1000molL1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000molL1Na2S2O3溶液滴定至终点。进行三次平行实验,测得平均消耗Na2S2O3溶液20.00mL。则产品的纯度为_____(计算结果保留四位有效数字)。滴定原理:CCl3CHO+OH-=CHCl3+HCOO-、HCOO-+I2=H++2I-+CO2、I2+2S2O32-=2I-+S4O62-