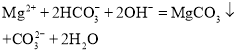题目内容
【题目】某温度时,在2L密闭容器中,X、Y、Z 三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析
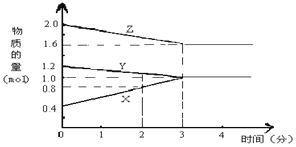
(1)该反应的化学方程式为________。
(2)反应开始至2min末,X的反应速率为_________。
(3)该反应____________。(填序号)
①是可逆反应
②不是可逆反应
【答案】2Z+Y![]() 3X 0.1 mol/(L·min) ①
3X 0.1 mol/(L·min) ①
【解析】
(1)根据图象可知Y、Z浓度降低,为反应物,X浓度增大为生成物,当物质的量不再变化时,达到平衡状态,此时△n(Y)=1.2mol-1.0mol=0.2mol,△n(Z)=2.0mol-1.6mol=0.4mol,△n(X)=1.0mol-0.4mol=0.6mol,计量数之比等于△n(Y):△n(Z):△n(X)=1:2:3,化学方程式可写为Y+2Z![]() X,故答案为:Y+2Z
X,故答案为:Y+2Z![]() 3X;
3X;
(2)反应开始至2min末,△n(X)=0.8mol-0.4mol=0.4mol,△c(X)=0.4mol/2L=0.2mol/L,化学反应速率为0.2mol/L/2min= 0.1 mol/(L·min),故答案为:0.1 mol/(L·min);
(3)3min后,各物质的物质的量不再发生变化,说明反应达到反应限度,即该反应是可逆反应,故答案为:①。

【题目】下列离子方程式书写及评价合理的是( )
选项 | 离子方程式 | 评价 |
A |
| 正确, |
B |
| 正确, |
C | 将少量的 | 正确, |
D | 将 | 错误, |
A.AB.BC.CD.D