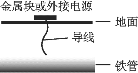
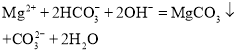题目内容
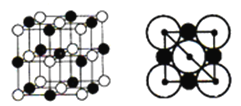
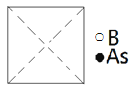
【题目】某公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。其中B电极的电极材料为碳,如图是一个电化学过程的示意图。请填空:
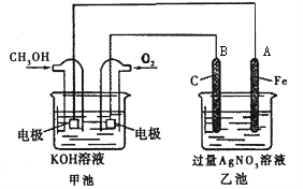
(1)放电时:正极参加反应气体22.4L(标准状况下),则转移电子的物质的量为___。
(2)在此过程中若完全反应,乙池中A极的质量增加216 g,则乙池中c(H+)=______(反应后溶液体积为2000mL)。
(3)若在常温常压下,1gCH3OH燃烧生成CO2和液态H2O时放热22.68kJ,表示甲醇燃烧热的热化学方程式为___。
【答案】4mol 1mol·L-1 CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-725.76kJ/mol
O2(g)=CO2(g)+2H2O(l) △H=-725.76kJ/mol
【解析】
(1)放电时,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,所以电极反应式为:CH3OH-6e-+8OH-═![]() +6H2O,正极:O2+4e-+2H2O=4OH-;
+6H2O,正极:O2+4e-+2H2O=4OH-;
(2)乙池是电解池,总反应为:4Ag++2H2O![]() 4Ag↓+4H++O2↑,乙池中A极上银离子得电子发生还原反应,根据方程式计算氢离子的浓度。
4Ag↓+4H++O2↑,乙池中A极上银离子得电子发生还原反应,根据方程式计算氢离子的浓度。
(3)n(CH3OH)=![]() mol,结合燃烧热的概念书写热化学方程式。
mol,结合燃烧热的概念书写热化学方程式。
(1)放电时:正极:O2+4e-+2H2O=4OH-,正极参加反应气体22.4L(标准状况下),则转移电子的物质的量为![]() =4mol。故答案为:4mol;
=4mol。故答案为:4mol;
(2)电解总反应为:4Ag++2H2O![]() 4Ag↓+4H++O2↑,乙池中A极上银离子得电子发生还原反应,生成的氢离子的物质的量与银的物质的量相同,A极的质量增加216 g,则乙池中c(H+)=
4Ag↓+4H++O2↑,乙池中A极上银离子得电子发生还原反应,生成的氢离子的物质的量与银的物质的量相同,A极的质量增加216 g,则乙池中c(H+)=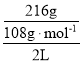 =1mol·L-1。故答案为:1mol·L-1;
=1mol·L-1。故答案为:1mol·L-1;
(3)n(CH3OH)=![]() mol,生成CO2和液态H2O时放热22.68kJ,则1molCH3OH燃烧生成CO2和液态H2O时放出的热量为22.68kJ×32=725.76kJ,表示甲醇燃烧热的热化学方程式为CH3OH(l)+
mol,生成CO2和液态H2O时放热22.68kJ,则1molCH3OH燃烧生成CO2和液态H2O时放出的热量为22.68kJ×32=725.76kJ,表示甲醇燃烧热的热化学方程式为CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-725.76kJ/mol。故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l) △H=-725.76kJ/mol。故答案为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-725.76kJ/mol。
O2(g)=CO2(g)+2H2O(l) △H=-725.76kJ/mol。

【题目】下列离子方程式书写及评价合理的是( )
选项 | 离子方程式 | 评价 |
A |
| 正确, |
B |
| 正确, |
C | 将少量的 | 正确, |
D | 将 | 错误, |
A.AB.BC.CD.D