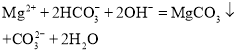题目内容
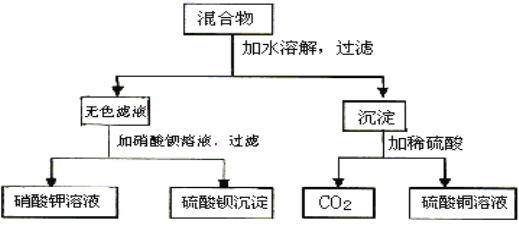
【题目】由A和B两种可溶性盐组成的混合物,进行了下列实验:
(1)若A溶液有颜色,试判断,A、B分别是_____________、_____________。(写化学式)
(2)写出实验过程中发生反应的离子方程式_____________、_____________、_____________。(顺序不限)
【答案】CuSO4 K2CO3 Cu2++CO32-=CuCO3↓ Ba2++SO42-=BaSO4↓ CuCO3+2H+=Cu2++CO2↑+H2O
【解析】
A和B两种可溶性盐组成的混合物,加水溶解后,过滤后所得无色溶液加入硝酸钡溶液可得硫酸钡沉淀和硝酸钾溶液,说明混合物中含有SO42-、K+;混合物加水溶解过滤所得沉淀加入稀硫酸得CO2,说明混合物中含有CO32-,最后得到硫酸铜溶液,则混合物中含有Cu2+;则混合物中含有:SO42-、Cu2+、CO32-、K+;这些离子可以组成两种可溶性物质是K2CO3、CuSO4,据此分析解答。
(1)根据分析,A、B两种可溶性物质是K2CO3、CuSO4,若A溶液有颜色,A为CuSO4、B为K2CO3;
(2)A、B两种盐K2CO3、CuSO4在溶解时,发生反应生成碳酸铜和硫酸钾,离子反应为:Cu2++CO32-=CuCO3↓,过滤后的溶液中加入硝酸钡,生成硫酸钡和硝酸钾,离子反应为:Ba2++SO42-=BaSO4↓,过滤得到的沉淀为碳酸铜,加入稀硫酸生成硫酸铜、二氧化碳和水,离子反应为:CuCO3+2H+=Cu2++CO2↑+H2O。

 53随堂测系列答案
53随堂测系列答案【题目】下列离子方程式书写及评价合理的是( )
选项 | 离子方程式 | 评价 |
A |
| 正确, |
B |
| 正确, |
C | 将少量的 | 正确, |
D | 将 | 错误, |
A.AB.BC.CD.D