题目内容
【题目】已知:2H2O2(l)=2H2O(l)+O2(g) ΔH=-akJ·mol-1(a>0)
(1)KI溶液可作为H2O2分解反应的催化剂,催化过程按以下两步反应进行:
Ⅰ.H2O2(l)+I-(aq)=H2O(l)+IO-(aq) ΔH1=+bkJ·mol-1(b>0)
Ⅱ.__ ΔH2=__kJ·mol-1(用含a和b的代数式表示)
①请将上述过程补充完整(提示:反应Ⅱ不是分解反应)。
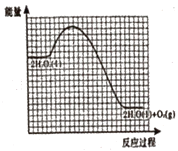
②已知:相同条件下,反应Ⅰ的反应速率小于反应Ⅱ的反应速率。如图为未加催化剂时H2O2分解反应的能量-反应历程示意图,请在图中画出加入KI溶液后该反应的能量-反应历程示意图___。
(2)H2O2的水溶液呈弱酸性,其电离过程如下:H2O2H++HO2-;HO2-H++O22-
某温度下,其电离平衡常数K1=1.1×10-11,则质量分数为30%(物质的量浓度为10mol·L-1)的H2O2水溶液的pH≈__。(忽略H2O2的二级电离及水的电离)。
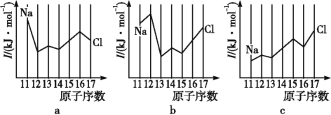
(3)为研究温度对H2O2分解速率的影响(不加催化剂),可将一定浓度和体积的H2O2置于密闭容器中,在某温度下,经过一定的时间t,测定生成O2的体积V。然后保持其它初始条件不变,改变温度![]() ,重复上述实验。获得V(O2)(转化成标况下的体积)~T关系曲线。下列趋势图可能符合实测V(O2)~T关系曲线的是__,原因是__。
,重复上述实验。获得V(O2)(转化成标况下的体积)~T关系曲线。下列趋势图可能符合实测V(O2)~T关系曲线的是__,原因是__。
A.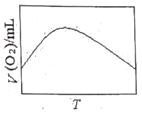 B.
B.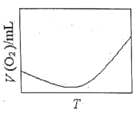
C.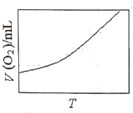 D.
D.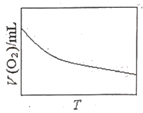
【答案】H2O2(l)+IO-(aq)=H2O(l)+I-(aq)+O2(g) -(a+b) 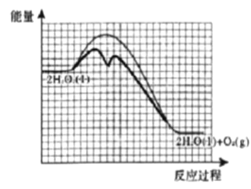 5 C 因该反应是不可逆反应,不考虑温度对平衡移动的影响。温度升高反应速率加快,因而经过相同反应时间后测得的O2体积随温度升高而增大
5 C 因该反应是不可逆反应,不考虑温度对平衡移动的影响。温度升高反应速率加快,因而经过相同反应时间后测得的O2体积随温度升高而增大
【解析】
(1)①根据盖斯定律解答;
②KI作催化剂,改变反应途径,降低反应的活化能,但反应热不变,以此分析;
(2)根据双氧水的第一步电离以及电离平衡常数表达式计算氢离子浓度,进而计算pH值;
(3) 根据温度对反应速率的影响考虑。
(1)①已知总反应:2H2O2(l)=2H2O(l)+O2(g)ΔH=-akJ·mol-1(a>0),反应Ⅰ:H2O2(l)+I-(aq)=H2O(l)+IO-(aq) ΔH1=+bkJ·mol-1(b>0),因H2O2分解反应中KI催化作用,则由盖斯定律可知,反应Ⅱ=总反应-反应Ⅰ,故反应Ⅱ为:H2O2(l)+IO(aq)=H2O(l)+O2(g)+I(aq)△H2=-(a+b)kJ/moL;
②过氧化氢分解生成氧气和水,KI作催化剂,改变反应途径,降低反应的活化能,但反应热不变,反应物的总能量和生成物的总能量不变,故H2O2溶液中加入KI后“反应过程-能量”示意图为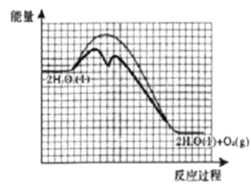 ;
;
(2) H2O2的水溶液呈弱酸性,第一步电离为:H2O2H++HO2-、其电离平衡常数K1=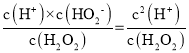 =1.1×10-11,则c(H+)=
=1.1×10-11,则c(H+)=![]() ≈1.0×10-5 mol·L-1,则pH≈5;
≈1.0×10-5 mol·L-1,则pH≈5;
(3)因该反应是不可逆反应,不考虑温度对平衡移动的影响,温度升高反应速率加快,因而经过相同反应时间后测得的O2体积随温度升高而增大,故C图象符合。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】下列离子方程式书写及评价合理的是( )
选项 | 离子方程式 | 评价 |
A |
| 正确, |
B |
| 正确, |
C | 将少量的 | 正确, |
D | 将 | 错误, |
A.AB.BC.CD.D