题目内容
5.卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于元素周期表的p区;溴的价电子排布式为4s24p5.
(2)测定液态氟化氢的相对分子质量,实验值大于20,原因是存在因氢键形成的缔合分子(HF)n.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘(写出名称).
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
请比较二者酸性强弱:HIO3>H5IO6(填“>”、“<”或“=”),原因是碘酸中非羟基氧原子数多,其正电性更高,导致I-O-H中O的电子更向I偏移,越易电离出氢离子,酸性强于高碘酸
(5)BCl3是一种非金属氯化物,其分子中B-Cl键的键角为120°,写出一种与BCl3互为等电子体的离子CO32-.
(6)如图3为碘晶体晶胞结构.有关说法中正确的是.
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(如图4)的密度为pg/cm3,NA为阿伏伽德罗常数.
①阳离子的配位数为8.
②晶胞边长a=$\root{3}{\frac{312}{ρ•{N}_{A}}}$cm(用含p、NA的代数式表示)
分析 (1)根据基态原子核外电子排布式中最后填入电子名称确定区域名称,溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子;
(2)F的非金属性很强,HF分子之间能形成氢键;
(3)元素的第一电离能越大,元素失电子能力越弱,得电子能力越强,元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子;
(4)根据含氧酸中,酸的元数取决于羟基氢的个数,含非羟基氧原子个数越多,酸性越强;
(5)根据价层电子对互斥理论来确定其杂化方式和分子的空间构型,然后判断键角;原子数、价电子数均相同的微粒互为等电子体;
(6)碘为分子晶体,晶胞中占据顶点和面心,据此分析;
(7)①利用均摊法确定每个晶胞中含有的钙离子、氟离子个数,然后确定配位数;
②根据ρ=$\frac{m}{V}$,V=a3计算.
解答 解:(1)卤族元素最后填入的电子为p电子,所以卤族元素位于元素周期表的p区;
溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子,所以其价电子排布式为:4s24p5,
故答案为:p;4s24p5;
(2)F的非金属性很强,HF分子之间能形成氢键,存在因氢键形成的缔合分子(HF)n,所以测定液态氟化氢的相对分子质量,实验值大于20;
故答案为:存在因氢键形成的缔合分子(HF)n;
(3)卤族元素包含:F、Cl、Br、I、At元素,元素的第一电离能越大,元素失电子能力越弱,得电子能力越强,元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子,从表中数据可知卤族元素中第一电离能最小的是I元素,则碘元素易失电子生成简单阳离子,
故答案为:碘;
(4)H5IO6(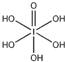 )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO3为一元酸,含有1个羟基氢,含非羟基氧原子2个,碘酸中非羟基氧原子数多,其正电性更高,导致I-O-H中O的电子更向I偏移,越易电离出氢离子,酸性强于高碘酸,所以酸性:H5IO6<HIO3,
)中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO3为一元酸,含有1个羟基氢,含非羟基氧原子2个,碘酸中非羟基氧原子数多,其正电性更高,导致I-O-H中O的电子更向I偏移,越易电离出氢离子,酸性强于高碘酸,所以酸性:H5IO6<HIO3,
故答案为:<;碘酸中非羟基氧原子数多,其正电性更高,导致I-O-H中O的电子更向I偏移,越易电离出氢离子,酸性强于高碘酸;
(5)BCl3中心B原子的价层电子对数=3+$\frac{3-3×1}{2}$=3,所以杂化方式为sp2杂化,没有孤电子对,分子的空间构型为平面三角形,则键角为120°;BCl3与CO32-具有相同的电子数目和原子数目,属于等电子体;
故答案为:120°;CO32-;
(6)A.碘分子的排列有2种不同的取向,在顶点和面心不同,2种取向不同的碘分子以4配位数交替配位形成层结构,故A正确;
B.碘分子位于顶点和面心,用均摊法可知平均每个晶胞中有4个碘分子,即有8个碘原子,故B错误;
C.碘晶体为无限延伸的空间结构,构成微粒为分子,是分子晶体,故C错误;
D.碘晶体中的碘原子间存在I-I非极性键,且晶体中分子之间存在范德华力,故D正确,
故答案为:AD;
(7)①在CaF2晶胞中每个Ca2+连接4个氟离子,但在下面一个晶胞中又连接4个氟离子,所以其配位数为8;
故答案为:8;
②晶胞中Ca2+数为$\frac{1}{2}$×6+$\frac{1}{8}$×8=4,F-数为8,ρ=$\frac{m}{V}$=$\frac{\frac{19×8+40×4}{{N}_{A}}}{{a}^{3}}$,则a=$\root{3}{\frac{312}{ρ•{N}_{A}}}$cm;
故答案为:$\root{3}{\frac{312}{ρ•{N}_{A}}}$.
点评 本题考查物质结构与性质,综合性强,涉及元素周期表、核外电子排布、分子结构与性质、电离能、晶体结构与性质、杂化轨道、等电子体、晶胞计算等,侧重对主干知识的考查,需要学生熟练掌握基础知识,题目难度中等.

元素推断题:
X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
X | Y |
|
| Z | W |
请回答下列问题:
(1)W位于周期表中第 周期,第 族。
(2)X可形成双原子分子,其分子的电子式是 ;Y和氢元素形成的10电子微粒中常见的+1价阳离子为 (填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为 。
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式 。
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡进有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式为 。
| A. | Na+的结构示意图为 | |
| B. | 纯碱的化学式为Na2CO3 | |
| C. | 在酸性条件下,蔗糖水解的化学方程式为C12H20O11+H2O→2C6H12O6(葡萄糖) | |
| D. | 高氯酸(HClO4)中氯元素的化合价为+7 |
| A. | PM2.5(直径小于或者等于2.5×10-6m的细颗粒物)分散在空气中形成的溶胶 | |
| B. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| C. | 自来水厂可使用Cl2和绿矾(FeSO4•7H2O) 进行自来水的消毒、净化,以改善水质 | |
| D. | 在食品包装袋中放入装有硅胶的透气小袋,可以防止食物氧化变质 |

 、
、 ;
; .
.