题目内容
【题目】SO2、NO是大气污染物,NH4NO3、H2SO4等是水体污染物,有效去除这些污染物是一项重要课题。
(1) NO、SO2可以先氧化,后用碱吸收。其氧化过程的反应原理如下:
NO(g)+O3(g)NO2(g)+O2(g);ΔH1=-200.9 kJ·mol-1
SO2(g)+O3(g)SO3(g)+O2(g);ΔH2=-241.6 kJ·mol-1
2SO2(g)+O2(g)2SO3(g);ΔH3=-196.6 kJ·mol-1
则反应2NO2(g)2NO(g)+O2(g)的ΔH= ________kJ·mol-1。
(2) 土壤中的硫循环如图所示,土壤中的黄铁矿(FeS2)在过程Ⅰ中会转化成硫酸亚铁和硫酸,该过程发生的化学方程式为________;某种反硫化细菌在过程Ⅱ中需要有乳酸参与反应消耗硫酸,生成H2S并伴有热量放出,那么乳酸除在反应中作还原剂外,还存在另一作用并解释原因:________。

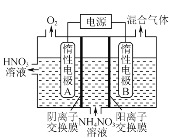
(3) 电解法除去工业废水中的硝酸铵的装置示意图如图所示,阴极电极反应式为_______。
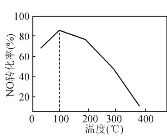
(4) 向恒容密闭容器中充入1 mol NO和2 mol O3,发生如下反应:NO(g)+O3(g)NO2(g)+O2(g);ΔH<0。不同温度下反应相同时间后,体系中NO转化率随温度变化曲线如图。温度低于100 ℃时,NO转化率随温度升高而增大的主要原因是________;当温度高时,O3分解生成活性极高的氧原子,NO转化率随温度升高而降低,可能的原因有:①________,②________。
【答案】+115.2 2FeS2+7O2+2H2O=2FeSO4+2H2SO4 因为过程Ⅱ(反硫化过程)吸热,乳酸和硫酸反应放出的热量使温度升高促进了过程Ⅱ(反硫化过程)的进行 2NH4++2e-=2NH3↑+H2↑ 低于100 ℃时,相同时间内反应未达到平衡。温度升高,化学反应速率加快,NO转化率高 温度高时,反应速率快,相同时间内已达到平衡,温度升高平衡左移 发生反应NO2+O=NO+O2
【解析】
(1)①已知NO(g)+O3(g) NO2(g)+O2(g)△H1=-200.9kJmol-1,②SO2(g)+O3(g) SO3(g)+O2(g)△H2=-241.6kJmol-1,③2SO2(g)+O2(g) 2SO3(g)△H3=-196.6kJmol-1,盖斯定律计算(②-①)×2得到反应2NO2(g) 2NO(g)+O2(g)的△H;
(2)土壤中的黄铁矿(FeS2)在过程Ⅰ中和氧气、水反应会转化成硫酸亚铁和硫酸;乳酸参与反应消耗硫酸,有热量放出使温度升高;
(3)装置图中放出氧气的为阳极,溶液中铵根离子在阴极得到电子生成混合气体为氨气和氢气;
(4)温度低于100℃时,NO转化率随温度升高而增大是反应速率增大,反应正向进行,已知温度高时,O3分解生成活性极高的氧原子,NO转化率随温度升高而降低,由于反应为放热反应,随温度升高平衡逆向进行,同时发生反应NO2+O=NO+O2使转化率降低。
(1)已知:①NO(g)+O3(g) NO2(g)+O2(g)△H1=-200.9kJmol-1,②SO2(g)+O3(g) SO3(g)+O2(g)△H2=-241.6kJmol-1,③2SO2(g)+O2(g) 2SO3(g)△H3=-196.6kJmol-1,盖斯定律计算(②-①)×2得到反应2NO2(g) 2NO(g)+O2(g)的△H=+115.2kJ/mol;
(2)土壤中的黄铁矿(FeS2)在过程Ⅰ中和氧气、水反应会转化成硫酸亚铁和硫酸,反应的化学方程式:2FeS2+7O2+2H2O=2FeSO4+2H2SO4;乳酸参与反应消耗硫酸,有热量放出使温度升高,答案为因为过程Ⅱ(反硫化过程)吸热,乳酸和硫酸反应放出的热量使温度升高促进了过程Ⅱ(反硫化过程)的进行
(3)电解法除去工业废水中的硝酸铵是铵根离子得到电子生成氨气和氢气,电极反应为2NH4++2e-=2NH3↑+H2↑;
(4)温度低于100℃时,NO转化率随温度升高而增大的主要原因是:低于100°C,反应速率慢相同时间内还没有达到平衡状态,已知温度高时,O3分解生成活性极高的氧原子,NO转化率随温度升高而降低,可能的原因有:温度高时反应速率快,相同时间内已经达到平衡状态,由于反应为放热反应,随温度升高平衡逆向进行,同时发生反应NO2+O=NO+O2使转化率降低。

 计算高手系列答案
计算高手系列答案【题目】已知:Fe2+遇铁氰化钾(K3[Fe(CN)6])会产生特征的蓝色沉淀;AgI是难溶于水的黄色固体。将0.2mol·L-1的KI溶液和0.05mol·L-1Fe2(SO4)3溶液等体积混合后,取混合液分别完成上述实验,能说明溶液中存在化学平衡“2Fe3++2I-![]() 2Fe2++I2”的是( )
2Fe2++I2”的是( )
编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 生成黄色沉淀 |
③ | 滴入K3[Fe(CN)6]溶液 | 生成蓝色沉淀 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A.①B.②和④C.③和④D.③