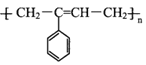
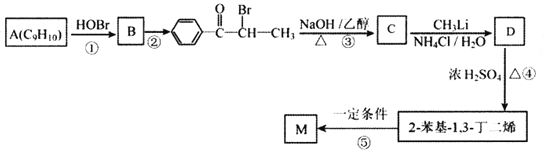
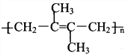
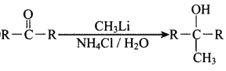题目内容
【题目】下列说法中正确的是( )
A.HF、HCl、![]() 、
、![]() 的稳定性依次增强
的稳定性依次增强
B.按Mg、Si、N、F的顺序,原子半径由小变大
C.某主族元素的电离能![]() 数据如下表所示
数据如下表所示![]() 单位:
单位:![]() ,可推测该元素位于元素周期表第ⅤA族
,可推测该元素位于元素周期表第ⅤA族
I | I | I | I | I | I | I |
578 |
|
|
|
|
|
|
D.在①P、S,②![]() 、Ca,③
、Ca,③![]() 、Si三组元素中,每组中第一电离能较大的元素的原子序数之和为41
、Si三组元素中,每组中第一电离能较大的元素的原子序数之和为41
【答案】D
【解析】
A.F、Cl位于同一主族,同主族从上到下,非金属性减弱,非金属性:F>Cl,P、S、Cl位于同一周期,同周期非金属性增强,非金属性:P<S<Cl,则非金属性F>Cl>S>P,HF、HCl、H2S、PH3的稳定性依次减弱,故A错误;
B.Mg、Si位于同一周期,同周期从左到右原子半径逐渐减小,Mg>Si,N、F位于同一周期,同周期从左到右原子半径逐渐减小,N>F ,Mg、Si位于N、F的下一周期故半径Mg>Si>N>F,原子半径是由大到小,故B错误;
C.表中电离能数据可知,突变在![]() 到
到![]() ,其常见化合价为+3价,故C错误;
,其常见化合价为+3价,故C错误;
D.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族,第VA族元素第一电离能大于其相邻元素,同一主族元素第一电离能随着原子序数增大而减小,①P,S中第一电离能较大的是P,②Mg,Ca中第一电离能较大的是Mg,③![]() 、Si中第一电离能较大的是Si,电离能较大的分别为P、Mg、Si,原子序数之和为
、Si中第一电离能较大的是Si,电离能较大的分别为P、Mg、Si,原子序数之和为![]() ,故D正确;
,故D正确;
答案选D。

 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案【题目】根据下列五种元素的电离能数据![]() 单位:
单位:![]() ,它们的最高价氧化物对应的水化物中,碱性最弱的是( )
,它们的最高价氧化物对应的水化物中,碱性最弱的是( )
元素代号 |
|
|
|
|
A | 420 | 3100 | 4400 | 5900 |
B | 500 | 4600 | 6900 | 9500 |
C | 740 | 1500 | 7700 | 10500 |
D | 580 | 1800 | 2700 | 11600 |
E | 2080 | 4000 | 6100 | 9400 |
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()