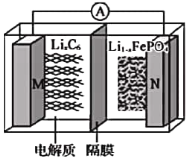
题目内容
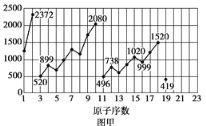
【题目】根据下列五种元素的电离能数据![]() 单位:
单位:![]() ,它们的最高价氧化物对应的水化物中,碱性最弱的是( )
,它们的最高价氧化物对应的水化物中,碱性最弱的是( )
元素代号 |
|
|
|
|
A | 420 | 3100 | 4400 | 5900 |
B | 500 | 4600 | 6900 | 9500 |
C | 740 | 1500 | 7700 | 10500 |
D | 580 | 1800 | 2700 | 11600 |
E | 2080 | 4000 | 6100 | 9400 |
A. 【答案】C 【解析】 基态的气态原子或气态离子失去一个电子所需要的最小能量称为元素的电离能,电离能越大,气态时原子越难失去电子,金属性越弱;电离能越小,气态时原子越容易失去电子,元素金属性越强,元素金属性越强,对应最高价氧化物水化物碱性越强,元素金属性越弱,对应最高价氧化物水化物碱性越弱。依据图中数据可知A、B、C、D四种元素中,C元素第一电离能最大,则其金属性最弱,对应最高价氧化物的水化物碱性越弱, 答案选C。![]() B.
B.![]() C.
C.![]() D.
D.![]()

英才教程探究习案课时精练系列答案

初中语文阅读轻松组合周周练系列答案

剑桥小学英语系列答案
作业本江西教育出版社系列答案
新起点百分百单元测试卷系列答案
状元口算计算系列答案
题库精选系列答案
复习与测评单元综合测试卷系列答案
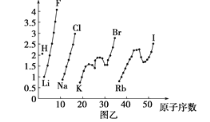
【题目】下列说法中正确的是( )
A.HF、HCl、![]() 、
、![]() 的稳定性依次增强
的稳定性依次增强
B.按Mg、Si、N、F的顺序,原子半径由小变大
C.某主族元素的电离能![]() 数据如下表所示
数据如下表所示![]() 单位:
单位:![]() ,可推测该元素位于元素周期表第ⅤA族
,可推测该元素位于元素周期表第ⅤA族
I | I | I | I | I | I | I |
578 |
|
|
|
|
|
|
D.在①P、S,②![]() 、Ca,③
、Ca,③![]() 、Si三组元素中,每组中第一电离能较大的元素的原子序数之和为41
、Si三组元素中,每组中第一电离能较大的元素的原子序数之和为41
【题目】已知X、Y是主族元素,I为电离能,单位是![]() 。请根据下表所列数据判断下列说法,其中错误的是
。请根据下表所列数据判断下列说法,其中错误的是![]()
![]()
元素 |
|
|
|
|
X | 500 | 4600 | 6900 | 9500 |
Y | 580 | 1800 | 2700 | 11600 |
A.元素X常见化合价是![]()
B.元素Y是第ⅢA族元素
C.同周期主族元素中,X的第一电离能最小
D.若元素Y处于第三周期,它可与冷水剧烈反应
【题目】甲醇是有机化工原料和优质燃料,主要应用于精细化工、塑料等领域,也是农药、医药的重要原料之一。回答下列问题:
(1)工业上利用CO2和H2反应合成甲醇。已知25℃ 101kPa下:
H2(g)+![]() O2(g)═H2O(g) △H=﹣242kJmol﹣1
O2(g)═H2O(g) △H=﹣242kJmol﹣1
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g)△H2=﹣676kJmol﹣1
O2(g)=CO2(g)+2H2O(g)△H2=﹣676kJmol﹣1
①写出CO2和H2反应生成CH3OH(g)与H2O(g)的热化学方程式______
②下列表示该合成甲醇反应的能量变化示意图中正确的是______(填字母)
a.  b.
b. 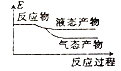 c.
c. 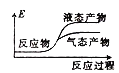 d.
d. 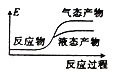
③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)H2(g)+CO2(g),某温度下该反应的平衡常数K=1,若起始时c(CO)=1molL﹣1,c(H2O)=2molL﹣1,则达到平衡时H2O的转化率为______
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)CH3OH(g)△H=﹣90.1kJmol﹣1,在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质浓度(molL﹣1)变化如下表所示(前6min没有改变条件)
2min | 4min | 6min | 8min | ||
CO | 0.07 | 0.06 | 0.06 | 0.05 | …… |
H2 | x | 0.12 | 0.12 | 0.2 | …… |
CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | …… |
①x=______,250℃时该反应的平衡常数K=______
②若6~8min时只改变了一个条件,则改变的条件是______,第8min时,该反应是否达到平衡状态?______(填“是”或“不是”)
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:
Ⅰ.此温度下的催化剂活性;
Ⅱ.______
(3)甲醇在催化剂条件下可以直接氧化成甲酸,在常温下,20.00mL 0.1000molL﹣1NaOH溶液与等体积、等浓度甲酸溶液混合后所得溶液的pH______(填“<”“>”或“=”)原因是______(用离子方程式表示)