题目内容
1.在氢气还原氧化铜的实验中( )| A. | 氧化铜发生还原反应 | B. | 氢气发生还原反应 | ||
| C. | 铜发生还原反应 | D. | 水发生还原反应 |
分析 氢气还原氧化铜生成Cu和水,Cu元素的化合价降低,H元素的化合价降低,以此来解答.
解答 解:Cu元素的化合价降低,CuO发生还原反应,故A正确;
B.H元素的化合价升高,氢气发生氧化反应,故B错误;
C.Cu元素得到电子被还原,发生还原反应,而Cu为生成物,故C错误;
D.水为生成物,为氧化产物,故D错误;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
11.pH=a的某电解质溶液中,插入两只惰性电极,通直流电一段时间后,停止电解,取出电极,将溶液摇匀,测得溶液的pH>a,则该电解质溶液是( )
| A. | K2SO4 | B. | NaOH | C. | NaCl | D. | AgNO3 |
12.下列说法正确的是( )
| A. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮罐贮运浓硫酸 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 检验Fe(NO3)2晶体是否已氧化变质,将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 | |
| D. | 常温下将Al片放入浓硝酸中,无明显变化,所以Al与浓硝酸不反应 |
16.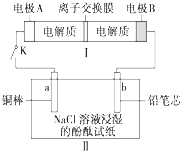 如图所示装置Ⅰ是一种可充电电池,装置Ⅱ为NaCl和酚酞和混合溶液浸湿的滤纸,离子交换膜只允许Na+通过,电池充电、放电的化学方程式为2Na2S2+NaBr3$\frac{\underline{\;放电\;}}{充电}$Na2S4+3NaBr.闭合开关K时,b极附近先变红色.下列说法正确的是( )
如图所示装置Ⅰ是一种可充电电池,装置Ⅱ为NaCl和酚酞和混合溶液浸湿的滤纸,离子交换膜只允许Na+通过,电池充电、放电的化学方程式为2Na2S2+NaBr3$\frac{\underline{\;放电\;}}{充电}$Na2S4+3NaBr.闭合开关K时,b极附近先变红色.下列说法正确的是( )
 如图所示装置Ⅰ是一种可充电电池,装置Ⅱ为NaCl和酚酞和混合溶液浸湿的滤纸,离子交换膜只允许Na+通过,电池充电、放电的化学方程式为2Na2S2+NaBr3$\frac{\underline{\;放电\;}}{充电}$Na2S4+3NaBr.闭合开关K时,b极附近先变红色.下列说法正确的是( )
如图所示装置Ⅰ是一种可充电电池,装置Ⅱ为NaCl和酚酞和混合溶液浸湿的滤纸,离子交换膜只允许Na+通过,电池充电、放电的化学方程式为2Na2S2+NaBr3$\frac{\underline{\;放电\;}}{充电}$Na2S4+3NaBr.闭合开关K时,b极附近先变红色.下列说法正确的是( )| A. | 电池充电时,电极B连接直流电源的正极 | |
| B. | 电池放电过程中Na+从左到右通过离子交换膜 | |
| C. | 闭合开关K后,b电极附近pH变小 | |
| D. | 当b电极上析出气体1120mL(标准状况)时,有0.1 molNa+通过离子交换膜 |
13.下列各组物质中,氮元素既有氧化性又有还原性的-组物质是( )
| A. | NH3、N2、NO、NO2 | B. | NO、NO2、N2O、N2O3 | ||
| C. | N2、N2O、NO2、N2O5 | D. | NH3、NO2、N2O4、HNO3 |