题目内容
11.取两份等质量的铝份和铁粉,分别与足量的盐酸反应,在相同状态下产生的气体体积之比是( )| A. | 1:1 | B. | 3:2 | C. | 28:9 | D. | 2:3 |
分析 根据n=$\frac{m}{M}$知,相同质量时,Al、Fe的物质的量之比等于其摩尔质量反比=56g/mol:27g/mol=56:27,Al、Fe和稀盐酸反应都生成氢气,根据转移电子和金属物质的量关系计算二者转移电子物质的量,再结合V=nVm计算二者体积之比.
解答 解:根据n=$\frac{m}{M}$知,相同质量时,Al、Fe的物质的量之比等于其摩尔质量反比=56g/mol:27g/mol=56:27,Al、Fe和稀盐酸反应都生成氢气,每个Al、Fe原子失电子个数之比为3:2,根据金属和转移电子关系知,生成气体物质的量之比=(56×3):(27×2)=28:9,转移电子物质的量之比与其生成氢气物质的量之比相等,根据V=nVm知,二者生成气体体积之比为28:9,故选C.
点评 本题考查化学方程式有关计算,为高频考点,明确各个物理量关系是解本题关键,注意:Fe和稀盐酸反应生成亚铁离子,Fe和氯气反应生成三价铁,题目难度不大.

练习册系列答案
相关题目
19.将Na2O2、Al2O3两种物质同时置于水中,待固体溶解后,向所得溶液中通入一定量HCl气体,所得溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为( )
| A. | 3:2:1 | B. | 2:4:1 | C. | 2:3:1 | D. | 4:2:1 |
3.在恒容密闭容器中,反应2A(g)?B(g)+C(g)△H<0达到化学平衡,下列说法正确的是( )
| A. | 升高温度,平衡常数增大 | |
| B. | 增大A的浓度,A的转化率不变 | |
| C. | 增大压强,化学平衡向正反应方向移动 | |
| D. | 增大B的浓度,A的转化率增大 |
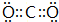 ;V原子的结构示意图
;V原子的结构示意图 ;Z的氢化物结构式为
;Z的氢化物结构式为 ;写出U元素在周期表中的位置第三周期VIA族;N2W2中含有的化学键有离子键、共价键(化学键类型)
;写出U元素在周期表中的位置第三周期VIA族;N2W2中含有的化学键有离子键、共价键(化学键类型)