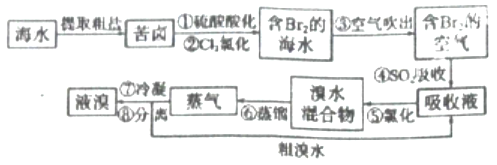
题目内容
【题目】A、B、C、D、E、F、G七种短周期主族元素,它们的原子序数依次增大。A 有一种原子,中子数为零。B 原子的最外层电子数是电子层数的2倍。D元素原子的最外层电子数是次外层电子数的 3 倍。E元素的一种氧化物颜色为淡黄色。F与D同主族。请回答下列问题:
(1)B元素在周期表中的位置是_____,G的离子结构示意图为_____。
(2)F与G最高价氧化物的水化物的酸性强弱为_________>_________(填化学式)。
(3)简单D离子和E离子的半径大小关系为_____>_________(填离子符号)。
(4) B和D简单气态氢化物的稳定性强弱为_____<_____(填化学式)
(5) F的一种氧化物中氧的质量分数为50%,写出该氧化物与G单质水溶液反应的化学方程式:___________________。
【答案】第二周期ⅣA族 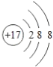 HClO4 H2SO4 O2- Na+ CH4 H2O SO2+Cl2+2H2O=H2SO4+2HCl
HClO4 H2SO4 O2- Na+ CH4 H2O SO2+Cl2+2H2O=H2SO4+2HCl
【解析】
A、B、C、D、E、F、G七种短周期主族元素,它们的原子序数依次增大。A有一种原子,中子数为零,则A为H元素;B原子的最外层电子数是其电子层数的2倍,由于最外层电子数不超过8,B原子只能有2个电子层,最外层电子数为4,则B核外电子排布为2、4,则B为C元素;D元素原子的最外层电子数是次外层电子数的3倍,则D核外电子排布为2、6,所以D为O元素,C原子序数介于C、O之间,则C为N元素;E元素的一种氧化物颜色为淡黄色,则E为Na,该氧化物为Na2O2; F与D同主族,则F是S元素,G是短周期元素,原子序数比S大,所以G为Cl元素,然后根据物质结构与性质关系分析解答。
根据上述分析可知:A是H,B是C,C是N,D是O,E是Na,F是S,G是Cl元素。
(1) B是C元素,核外电子排布为2、4,所以C元素在周期表的位置是位于第二周期第IVA族;G是Cl元素,原子核外有17个电子,Cl原子得到1个电子变为2、8、8电子层结构,所以Cl-的离子结构示意图为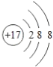 ;
;
(2)同一周期元素,原子序数越大,元素的非金属性就越强,元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。F是S,G是Cl元素,由于元素的非金属性S>Cl,所以酸性:HClO4>H2SO4;
(3) D是O,E是Na,二者形成离子核外电子排布为2、8。对于电子层结构相同的离子,核电荷数越大,离子半径越小,所以离子半径大小关系为O2->Na+;
(4)元素的非金属性越强,其简单氢化物的稳定性就越强。B是C元素, D是O,由于非金属性O>C,所以氢化物的稳定性强弱关系为CH4<H2O;
(5) F是S元素,S的氧化物有SO2、SO3,若F的一种氧化物中氧的质量分数为50%,则该氧化物为SO2,G是Cl元素,其单质Cl2具有氧化性,SO2具有还原性,二者在水溶液中会发生氧化还原反应产生盐酸和硫酸,反应方程式为:SO2+Cl2+2H2O=H2SO4+2HCl。