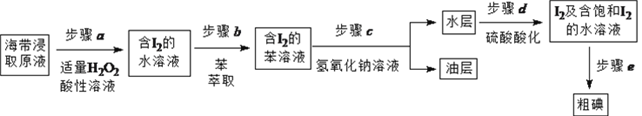题目内容
【题目】如图为实验室中过氧乙酸消毒液试剂瓶标签上的有关数据,回答下列问题:

(1)C2H4O3的物质的是浓度为___ mol·L-1。
(2)取用任意体积的该过氧乙酸溶液时,下列物理量中不随所取体积的多少而变化的是___。
A.溶液中C2H4O3的物质的量
B.C2H4O3的物质的量浓度
C.溶液的密度
D.溶液中C2H4O3分子的数目
(3)某学生欲用上述溶液和蒸馏水配制480mL0.100mol·L-1过氧乙酸稀溶液。
①该学生需要选用的容量瓶规格是___ mL。
②该学生需要用量筒量取___ mL上述过氧乙酸溶液进行配制。
③在配制过程中,下列实验操作会使所配制的过氧乙酸的物质的是浓度偏大的是___ (填字母)。
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容
B.用量筒量取过氧乙酸溶液时俯视凹液面
C.在容量瓶中定容时俯视刻度线
D.定容后把容量瓶倒置摇匀,发现液面低于刻度线,又加水至刻度线
(4)室温下,过氧乙酸可以分解放出氧气并生成酷酸(C2H4O2),若取质量分数为15%的过氧乙酸溶液50.0mL,完全分解,理论上得到标准状况下的氧气体积为___ L。
【答案】2.25 BC 500 22.2 C 1.26
【解析】
(1)根据![]() 可得,C2H4O3的物质的是浓度为
可得,C2H4O3的物质的是浓度为![]() ,故答案为:2.25;
,故答案为:2.25;
(2)取用任意体积的该过氧乙酸溶液时,物质的量浓度和密度不变,物质的量和分子数会发生改变,选BC,故答案为:BC;
(3)某学生欲用上述溶液和蒸馏水配制480mL0.100mol·L-1过氧乙酸稀溶液。
①实验室没有480mL的容量瓶,应选用500mL的容量瓶,故答案为:500;
②根据![]() 可得,
可得,![]() ,
,![]() ,故答案为:22.2;
,故答案为:22.2;
③A. 转移溶液后未洗涤烧杯和玻璃棒就直接定容,溶质物质的量减小,所配制的溶液浓度偏小,不选A;
B. 用量筒量取过氧乙酸溶液时俯视凹液面,所量取的过氧乙酸溶液偏小,物质的量偏小,所配制的溶液浓度偏小,不选B;
C. 在容量瓶中定容时俯视刻度线,所配溶液的体积偏小,则物质的量浓度偏大,选C;
D. 定容后把容量瓶倒置摇匀,发现液面低于刻度线,又加水至刻度线,相当于稀释,所配制的溶液浓度偏小,D;故答案为:C。
(4)过氧乙酸的物质的量浓度为2.25mol/L,其物质的量为:0.05L×2.25mol/L=0.1125mol,根据反应方程式2CH3COOOH=2CH3COOH+O2↑,氧气的物质的量为:n=0.05625mol,则氧气的体积为:V=n·Vm=0.05625mol×22.4L/mol=1.26L,故答案为:1.26。

 53随堂测系列答案
53随堂测系列答案【题目】某酸性废液含有H+、Fe3+、Ni2+、NO3—、F-和Cr2O72-等。下图是该废液的综合利用工艺流程:(假设: F—与金属离子的络合反应不影响其它反应和计算)
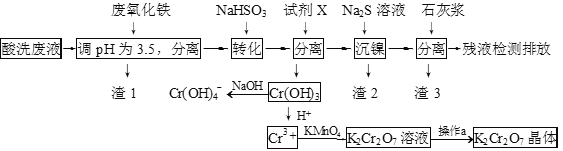
已知:金属离子开始沉淀和沉淀完全时的pH:
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
Ni2+与足量氨水的反应为:Ni2++6NH3 ![]() [Ni(NH3)6]2+([Ni(NH3)6]2+为难电离的络合离子)
[Ni(NH3)6]2+([Ni(NH3)6]2+为难电离的络合离子)
(1)滤渣1的主要成分为:____________。
(2)试剂X可以是足量氨水,还可以是:____________ 。(填序号)
A.Ni(OH)2 B.Cr2O3 C.Fe2O3 D.NaOH
(3)若试剂X是足量氨水,“沉镍”的离子方程式为:____________。
(4)经检测,最后的残液中c(Ca2+)=1.0×10─5 molL-1,则残液中F-浓度____________(填 “符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10-11,国家排放标准要求氟离子浓度小于10 mgL─1]。
(5)镍(Ni)及其化合物广泛应用于生产电池、电镀和催化剂等领域。
①某蓄电池反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2,放电时若外电路中转移0.6mol电子则正极增重____g。
Fe(OH)2+Ni(OH)2,放电时若外电路中转移0.6mol电子则正极增重____g。
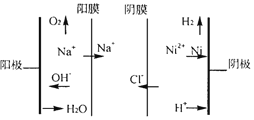
②图为双膜三室电解法处理含镍废水回收金属镍的原理示意图,阳极的电极反应式为____;电解过程中,需要控制溶液pH值为4左右,原因是_______。