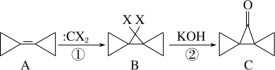
题目内容
【题目】等物质的量的铁和铜的混合物24g与600mL稀硝酸恰好完全反应,生成NO6.72L(标准状况)。向反应后的溶液中加入1molL-1NaOH溶液使金属离子恰好沉淀。下列有关说法错误的是( )
A.混合物溶解后的溶液中c(Fe3+):c(Fe2+)=1:1
B.稀硝酸的物质的量浓度度是2molL-1
C.需要加入NaOH溶液1000mL
D.最后所得沉淀在空气中充分加热可得固体32g
【答案】C
【解析】
铁和铜的混合物24g,物质的量为![]() ,而6.72L(标准状况)NO 的物质的量为:
,而6.72L(标准状况)NO 的物质的量为:![]() ,所以0.2mol的铁和铜的混合物共转移0.3mol×3=0.9mole-,即需氢氧化钠0.9mol,
,所以0.2mol的铁和铜的混合物共转移0.3mol×3=0.9mole-,即需氢氧化钠0.9mol,
A.如果铁全部变成三价铁,共转移0.2×3+0.2×2=1mole-,所以有一部分铁是亚铁离子,设亚铁离子的物质的量为xmol,则铁离子为(0.2-x)mol,根据转移电子数目相等,可知2x+3(0.2-x)=0.9-0.4,所以x=0.1mol,所以混合物溶解后的溶液中c(Fe3+):c(Fe2+)=1:1,故A正确;
B.硝酸的物质的量浓度是![]() ,故B正确;
,故B正确;
C.需加入NaOH溶液的体积为:![]() ,故C错误;
,故C错误;
D.最后所得沉淀在空气中充分加热可得氧化铁和氧化铜的固体混合物,质量为:0.1×160+0.2×80=32g,故D正确;
故答案选C。

【题目】GaN是制造5G芯片的材料,氮化镓铝和氮化铝LED可发出紫外光。回答下列问题:
(1)基态As原子核外电子排布式为[Ar]____________;下列状态的铝元素中,电离最外层的一个电子所需能量最小的是______________(填标号)。
A. B.
B.![]() C.
C.![]() D.
D.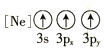
(2)8—羟基喹啉合铝(分子式C27H18AlN3O3)用于发光材料及电子传输材料,可由LiAlH4与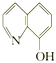 8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为______________; 8—羟基喹啉合铝中所含元素电负性最大的是______________(填元素符号,下同),第一电离能最大的是__________(填元素符号),N原子的杂化方式为_____________。
8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为______________; 8—羟基喹啉合铝中所含元素电负性最大的是______________(填元素符号,下同),第一电离能最大的是__________(填元素符号),N原子的杂化方式为_____________。
(3)已知下列化合物的熔点:
化合物 | AlF3 | GaF3 | AlCl3 |
熔点/℃ | 1040 | 1000 | 194 |
①表格中卤化物的熔点产生差异的原因是_______________________________________________。
②熔融AlCl3时可生成具有挥发性的二聚体Al2Cl6分子,分子中每个原子最外层均达到8电子,二聚体Al2Cl6的结构式为______________________________;其中Al的配位数为_________。