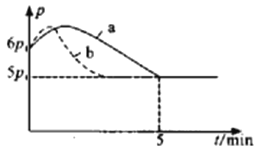
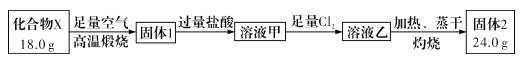
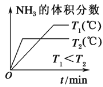
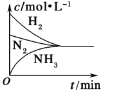
题目内容
【题目】某温度(T ℃)时,测得0.01 mol·L-1NaOH溶液的pH=11,则该温度下水的Kw=________。在此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合。
(1)若所得混合液为中性,且a=11,b=3,则Va∶Vb=__________。
(2)若所得混合液为中性,且Va∶Vb=10∶1,则a+b=__________。
(3)若所得混合液的pH=10,且a=12,b=2,则Va∶Vb=__________。
【答案】1×10-13 1∶10 12 1∶9
【解析】
0.01mol/L的NaOH溶液的pH为11,则c(H+)=1×10-11mol/L,c(OH-)=0.01mol/L,根据Kw=c(H+)×c(OH-)计算;
(1)混合溶液呈中性,且硫酸和氢氧化钠都是强电解质,所以酸中氢离子物质的量和碱中氢氧根离子的物质的量相等;
(2)混合溶液呈中性,且硫酸和氢氧化钠都是强电解质,所以酸中氢离子物质的量和碱中氢氧根离子的物质的量相等;
(3)若所得混合溶液的pH=10,碱过量,计算出c(OH-)与酸碱的物质的量的关系,据此计算。
0.01mol/L的NaOH溶液的pH为11,则c(H+)=1×1011mol/L,c(OH)=0.01mol/L,Kw=c(H+)×c(OH)=1×1013,故答案为:1×1013;
(1)混合溶液呈中性,且硫酸和氢氧化钠都是强电解质,所以酸中氢离子物质的量和碱中氢氧根离子的物质的量相等,pH=a的NaOH溶液中氢氧根离子浓度=10a13mol/L,pH=b的H2SO4溶液氢离子浓度=10bmol/L,10a13mol/L×Va L=10bmol/L×Vb L,且a=11,b=3,则Va:Vb=1:10,
故答案为:1:10;
(2)若Va:Vb=10:1,混合溶液呈中性,则10a13 mol/L×10V L=10b mol/L×VL,解得a+b=12,
故答案为:12;
(3)若所得混合溶液的pH=10,碱过量,且a=12,b=2,则溶液中c(OH)=![]() =0.001,则Va:Vb=1:9;
=0.001,则Va:Vb=1:9;
故答案为:1:9。

 名校课堂系列答案
名校课堂系列答案【题目】已知常温下浓度为0.lmol/L的下列溶液的pH如下表,下列有关说法正确的是( )
溶质 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序: H2CO3< HClO<HF
B.向上述NaC1O溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>(H+)>c(HClO) >c(OH-)
C.根据上表,水解方程式ClO-+H2O![]() HClO+OH-的水解常数K=10-7.6
HClO+OH-的水解常数K=10-7.6
D.若将CO2通入0.lmol/LNa2CO3溶液中至溶液中性,则溶液中2c(CO32-)+c(HCO3-)=0.1 mol/L