题目内容
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
①NH4Cl固体;②硫酸;③NaOH固体;④水;⑤加热;⑥加入少量MgCl2固体。
A.①②③⑤B.③⑥C.③D.③⑤
【答案】C
【解析】
①加入氯化铵固体,铵根离子浓度增大,平衡逆向移动,氢氧根浓度减小,故①错误;
②加入硫酸,氢离子中和氢氧根使之浓度减少,继而引发电离平衡正向移动,故②错误;
③加入氢氧化钠固体,氢氧根浓度增大,平衡逆向移动,故③正确;
④加水稀释使电离平衡相关的微粒浓度都减小,平衡向电离方向移动,故④错误;
⑤弱电解质的电离是吸热过程,加热使平衡向右移动,故⑤错误;
⑥加入少量硫酸镁固体,镁离子与氢氧根反应,使溶液中氢氧根浓度减小,稀氨水的电离平衡正向移动,故⑥错误。故只有③正确。
综上所述,答案为B。

练习册系列答案
相关题目
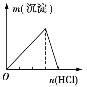
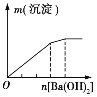
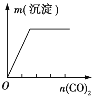
【题目】下列实验与图象对应的是
选项 | A | B | C | D |
实验 | NaAlO2溶液中逐滴滴加盐酸至过量 | AlCl3溶液中逐滴滴加氨水至过量 | 明矾溶液中逐滴滴加Ba(OH)2溶液至过量 | 澄清石灰水中缓慢通入CO2至过量 |
图象 |
|
|
|
|
A. AB. BC. CD. D
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变